
【题目】在粗食盐中除泥沙外,还含Na2SO4、MgCl2、CaCl2等杂质,工业制精盐除杂时,常常加入过量的除杂剂,现提供下列试剂:a.NaOH溶液;b.盐酸;c.BaCl2溶液;d.Na2CO3溶液,则加入试剂和操作不正确的是( )
A.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
B.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
C.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
D.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
科目:高中化学 来源: 题型:
【题目】高分子化合物G( )是一种重要的合成聚酯纤维,其合成路线如下:
)是一种重要的合成聚酯纤维,其合成路线如下:

已知:
① +
+ +R2OH
+R2OH
② +R3OH
+R3OH![]()
 +R2OH
+R2OH
(1)F的结构简式为_______________,①的反应类型为______________,E中官能团名称为______________,⑤的反应方程式为______________。
(2)写出符合下列条件E的同分异构体______________(填结构简式,不考虑立体异构)。
①含有苯环,遇![]() 溶液不变色
溶液不变色
②能发生银镜反应
③核磁共振氢光谱图峰面积之比为1:3:6:6
(3)判断化合物E中有无手性碳原子,若有,用“*”标出_________。
(4)写出以1,3-丙二醇和甲醇为原料制备 的合成路线(其它试剂任选)___________
的合成路线(其它试剂任选)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下:
离子 |
|
|
|
|
|
|
|
|
培养液浓度 | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。
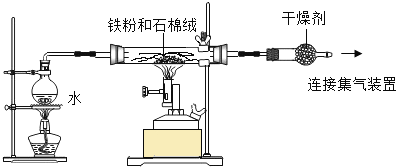
资料:在不同温度下,铁粉与水蒸气反应的产物不同。
Fe +H2O![]() FeO+H2 3Fe + 4H2O
FeO+H2 3Fe + 4H2O![]() Fe3O4 + 4H2
Fe3O4 + 4H2
实验一:某兴趣小组用下图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。
(1)实验过程中,应先点燃___________(选填“酒精灯”或“酒精喷灯”);目的是__________________,装置中石棉绒的作用是_____________________。
(2)若在实验中的某段时间内生成H2 0.2g,则这段时间内参加反应的铁粉质量至少是___________g。
实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图。
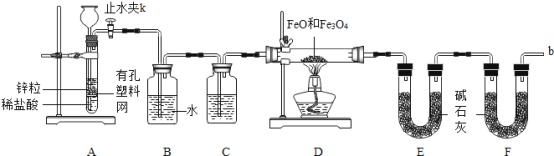
(1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差__________,则气密性良好。
(2)装置A中发生的反应方程式_______________________________________。
(3)为了安全,在点燃酒精灯之前,在F装置出口b处必须______________________。
(4)装置C中所放试剂为_________,装置B的作用是_________________________。
(5)干燥管E右边又连接干燥管F的目的是_________________________________。
若无干燥管F,测得Fe3O4的质量将_______________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要含 AlF3、 NaF、LiF、CaO ) 和浓硫酸为原料,制备电池级碳酸锂,同时得副产品冰晶石,其工艺流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)电解铝废渣与浓硫酸反应产生的气体化学式为 ___________。滤渣2的主要成分是(写化学式)_________。
(2)碱解反应中, 同时得到气体和沉淀反应的离子方程式为_____________。
(3)一般地说 K>105 时,该反应进行得就基本完全了。苛化反应中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通过计算说明该反应是否进行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反应后的溶液得到Li2CO3的具体实验操作有:加热浓缩、______、______、干燥。
(5)上述流程得到副产品冰晶石的化学方程式为__________。
(6)Li2CO3是制备金属锂的重要原料, 一种制备金属锂的新方法获得国家发明专利,其装置如图所示:

工作时电极 C 应连接电源的______极,阳极的电极反应式为__________ 。该方法设计的 A 区能避免熔融碳酸锂对设备的腐蚀和因________逸出对环境的污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)天然气的主要成分是_____(写化学式),其分子空间构型是_____;
(2)苯与液溴在铁粉为催化剂时发生反应的化学方程式_____;反应类型为_____;
(3)写出Na与水反应的离子方程式_____;
(4)CH2=CH﹣CH=CH2与H2在一定条件下发生1,4﹣加成反应的化学方程式_____;
(5)萘的结构简式是![]() ,其分子式_____;一氯代物有_____种。
,其分子式_____;一氯代物有_____种。
(6)某摩尔质量为42gmol﹣1的链烃A可使溴水褪色,A的结构简式为_____;A在一定条件下可以发生加聚反应,产物的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe3++Cr2+![]() Fe2++Cr3+,工作示意图如图。下列说法错误的是
Fe2++Cr3+,工作示意图如图。下列说法错误的是

A.放电时a电极反应为Fe 3++e=Fe2+
B.充电时b电极反应为Cr3++e=Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:______________________。
(2)H3PO2及NaH2PO2均可将AgNO3溶液中的Ag+ 还原为银,从而可用于化学镀银。
①H3PO2中,磷元素的化合价为______。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出该反应的化学方程式,并在方程式中用单线桥表示该反应的电子转移:_______。
③NaH2PO2为____________ (填“正盐”或“酸式盐”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com