
【题目】按要求填些对应的化学符号
(1)质量数为37的氯原子符号为________。
(2)S2-的结构示意图________。
(3) N2的电子式________
(4)磷原子的核外电子排布式__________铬原子价电子排布图_____________
(5)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为__________。
(6)B元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为___________
(7)O、N、F 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)
(8)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。四种元素中,D元素在周期表中的位置____第一电离能最小的是_____(填元素符号,下同),电负性最大的是______
(9)已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化学式为XY4的物质。试回答:
X元素原子的基态电子排布式为__________
Y元素原子最外层电子的轨道表示式为________
若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为_______(填“共价键”或“离子键”)。
【答案】![]() Cl
Cl ![]()
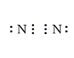 1s22s22p63s23p3
1s22s22p63s23p3 ![]() C或O 1s22s22p63s23p63d64s2或[Ar]3d64s2 F>N>O 第四周期第VIII族 K F 1s22s22p63s23p63d104s24p2
C或O 1s22s22p63s23p63d64s2或[Ar]3d64s2 F>N>O 第四周期第VIII族 K F 1s22s22p63s23p63d104s24p2 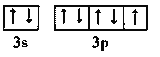 共价键
共价键
【解析】
(1)Cl的质子数为17,质量数为37,则质量数为37的氯原子符号为![]() Cl;
Cl;
(2)硫离子最外层得到两个电子达到8电子稳定结构,所以其结构示意图为:![]() ;
;
(3)氮气分子中氮原子之间以氮氮三键形成氮分子,其电子式为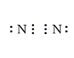 ;
;
(4)磷元素核外有15个电子,根据书写规则知有3层,s轨道最多容纳两个电子,p轨道最多容纳6个电子,所以磷原子的核外电子排布式为1s22s22p63s23p3或[Ne]3s23p3;
铬是24号元素,其原子核外有24个电子,3d能级上有5个电子、4s能级上有1个电子,3d、4s电子为其价电子,所以其价电子排布图为![]() ;
;
(5)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,原子只能有2个电子层,核外电子排布式为1s22s22p2或1s22s22p4,为C或O;
(6)某元素的正三价离子的3d轨道为半充满,3d轨道电子数为5,该三价离子的电子排布式为1s22s22p63s23p63d5,则该元素基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(7)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,F、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能F>N>O;
(8)前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,价电子排布式分别为3d64s2、3d84s2,则C是Fe元素,D是Ni元素。
D为Ni元素,在周期表中的位置第四周期第VIII族;
四种元素中K的金属性最强,F的非金属性最强,故第一电离最小的是K,电负性最大的是F;
(9)由题意知,X元素为Ge元素,Y元素为Cl元素,原子结构示意图为 。
。
Ge元素原子的基态电子排布式为:1s22s22p63s23p63d104s24p2;Cl元素原子最外层电子的轨道表达式为 ;
;
Ge、Cl两元素的电负性差值为0.75,数值较小,所以二者形成共价键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:
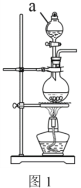
仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述。在基态原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________。
(3)CS2分子中,共价键的类型有_____________,C原子的杂化轨道类型是_______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
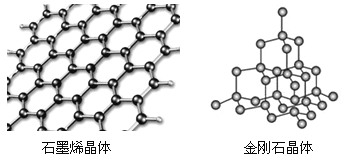
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 醋酸溶解水垢中的CaCO3: CaCO3 + 2H+= Ca2++ H2O + CO2↑
B. 惰性电极电解饱和MgCl2溶液: Mg2++2Cl- + 2H2O ![]() Mg(OH)2↓ + H2↑ + Cl2↑
Mg(OH)2↓ + H2↑ + Cl2↑
C. 苯酚钠溶液中通入少量的CO2:![]() +H2O+CO2→
+H2O+CO2→ +
+![]()
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+![]() +2OH-
+2OH-![]() CH3COONH4+H2O+2Ag↓+3NH3↑
CH3COONH4+H2O+2Ag↓+3NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将112mLCl2(标准状况)通入5mL1mol/L的FeBr2溶液中(还原性:Fe2+大于Br-),发生反应的离子方程式是( )
A.Cl2+2Br-=2Cl-+Br2B.2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
C.2Fe2++Cl2=2Fe3++2Cl-D.2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是
A.Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂
B.KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原
C.凡是氧化还原反应都能造福人类
D.在反应2H2O![]() 2H2↑+ O2↑中H2O是还原剂
2H2↑+ O2↑中H2O是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氧原子的相对原子质量为12a/b
②m g该氧原子的物质的量为m/(aNA) mol
③该氧原子的摩尔质量是aNA g
④a g该氧原子所含的电子数为8 mol
A. ①③B. ②④C. ①②D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程的离子方程式书写正确的是( )
A.Cu与AgNO3溶液反应: Cu + Ag+![]() Ag + Cu2+
Ag + Cu2+
B.醋酸与氢氧化钠溶液反应: CH3COOH + OH![]() CH3COO + H2O
CH3COO + H2O
C.碳酸氢钠与硫酸反应: CO32 + 2H+![]() CO2↑ + H2O
CO2↑ + H2O
D.氢氧化铁胶体的制备:Fe2+ + 3H2O ![]() Fe(OH)3↓ + 3H+
Fe(OH)3↓ + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH两种反应物的初始浓度均为0.050mol/L,在不同温度下测得O2NC6H4COOC2H5的浓度(mol/L)随时间变化的数据如下表所示。下列有关说法不正确的是( )
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15℃ | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35℃ | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | … | 0.135 | 0.135 | 0.135 |
A. 该反应在![]() ,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
B. 由数据可知,随着反应的进行,反应物的浓度降低,反应速率减慢
C. 530s时,表格中35℃对应的数据一定是0.135
D. 由数据可知,温度升高反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com