
【题目】下列有关实验说法,不正确的是( )
A.碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗
B.![]() 和
和![]() 的混合物经溶解、过滤,洗涤、干燥,可分离出
的混合物经溶解、过滤,洗涤、干燥,可分离出![]()
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加![]() 溶液,稀
溶液,稀![]() 和
和![]() 溶液,可检验火柴头是否含有氯元素
溶液,可检验火柴头是否含有氯元素
【答案】C
【解析】
A. 若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,避免皮肤受损,故A正确;
B.二氧化锰不溶于水,氯化钾可溶于水,所以混合物经溶解、过滤,洗涤、干燥,可分离出![]() ,故B正确;
,故B正确;
C.滴管吸出的液体中含有溶质,因此会导致所配溶液浓度偏小,正确操作应该是重新配制,故C错误;
D. 火柴头中含有KClO3,检验氯元素,应把ClO3-还原为4Cl-,酸性条件下,NO2-具有还原性,向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,发生的离子反应为:ClO3-+3NO2-+Ag+═AgCl↓+3NO3-,出现白色沉淀,证明含有氯元素,故D正确;
故答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室中用足量的MnO2和含有4 mol溶质的浓盐酸充分反应制氯气,下列说法正确的是( )
A. 该实验中共消耗1 mol MnO2,生成1 mol氯气
B. 为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C. 在该反应中MnO2作氧化剂,浓盐酸作还原剂
D. 氯气可以用向上排空气法或排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为______。
②完成NaClO3氧化FeCl2的离子方程式:
___![]() +___Fe2++___=___Cl+___Fe3++__
+___Fe2++___=___Cl+___Fe3++__
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]()
![]() +H+ K2
+H+ K2
![]() +H2O
+H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_____mg·L-1。
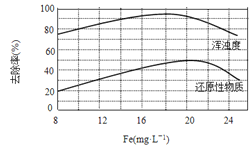
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R元素无同位素。21gR2+金属离子内含有22×3.01×1023个中子,取等质量的该元素单质与酸反应,在标准状况下生成11.2LH2。
(1)21g R2+金属阳离子中含有_________mol质子?_________________mol电子?
(2)R是__________元素?写出该元素原子核的组成_______________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)。下列说法错误的是( )
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32—
+CO32—
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为
①C3N3(OH)3![]() 3HNCO
3HNCO
②8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
A.反应①是氧化还原反应
B.反应②中HNCO是氧化剂
C.反应②中,每转移1 mol电子,消耗NO2 0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:
3C(g)。反应过程中的部分数据如下表所示:
n/mol t/min | n(A) | n(B) | n(C) |
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L-1·min-1
B.该反应在10min后才达到平衡
C.物质B的平衡转化率为20%
D.平衡状态时,c(C)=0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)相同质量的CO和CO2,它们所含的原子数之比为___________,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____________。
(2)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(3)标准状况下有①0.112 L水 ②0.5NA个HCl分子 ③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne 所含原子个数从大到小的顺序为___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com