
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
【答案】![]() 0.5 >
0.5 >
【解析】
①先计算出v(C3H6),然后根据二者反应时的物质的量关系,计算v(C4H8);
②根据平衡常数K的含义,将各种物质的浓度带入定义式,就得到K的值;
③t1min时再往容器内通入等物质的量的C4H8和C2H4,导致容器内气体的物质的量增大,根据浓度商与K大小判断平衡移动方向分析与![]() 的大小;
的大小;
①平衡时n(C3H6)=nmol,n(C4H8)=mmol,n(C2H4)=2mmol,平衡时C3H6的体积分数为![]() 。则
。则![]() ,解得n=m。从反应开始至平衡,v(C3H6)=
,解得n=m。从反应开始至平衡,v(C3H6)=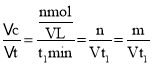 mol/(Lmin),根据方程式可知v(C4H8)=
mol/(Lmin),根据方程式可知v(C4H8)=![]() v(C3H6)=
v(C3H6)=![]() mol/(Lmin);
mol/(Lmin);
②该反应是反应前后气体体积相等的反应,所以它们的浓度比等于二者的物质的量的比,则此反应的平衡常数K=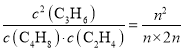 =0.5;
=0.5;
③t1min时达到平衡,此时n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() ,通过前面①的计算可知m=n,现在再往容器内通入等物质的量的C4H8和C2H4,使容器内气体压强增大,假设C4H8改变量为x,根据反应列“三段式”:
,通过前面①的计算可知m=n,现在再往容器内通入等物质的量的C4H8和C2H4,使容器内气体压强增大,假设C4H8改变量为x,根据反应列“三段式”:
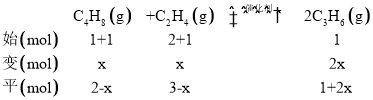
由于反应是等体积的反应,所以浓度比等于物质的量的比,平衡常数表达式用物质的量数值带入,结果不变。假设C3H6的含量不变,仍然为![]() ,则
,则![]() ,解得x=
,解得x=![]() ,则Qc=
,则Qc=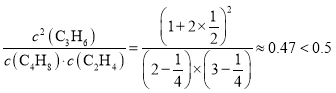 ,说明再往容器内通入等物质的量的C4H8和C2H4,化学平衡向正反应方向移动,因此再达到新平衡时C3H6的体积分数>
,说明再往容器内通入等物质的量的C4H8和C2H4,化学平衡向正反应方向移动,因此再达到新平衡时C3H6的体积分数>![]() 。
。


科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列说法正确的是( )
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O+4e-=O2↑+4H+
B. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物可能为H3PO4
C. H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-= PO23-+3H2O
D. H3PO2溶于水的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料。已知:
CH3OH(l)+O2(g)![]() CO(g)+2H2O(g)
CO(g)+2H2O(g)![]() ;
;
2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)![]() 。
。
下列说法或热化学方程式正确的是
A.CO的燃烧热为![]()
B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低
C.2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g)
2CO2(g)+4H2O(g)![]()
D.完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在加热条件下进行的反应不一定是吸热反应
C.由3O2(g)=2O3(g)H=+284.2kJ/mol,可知O2比O3稳定
D.已知,H2(g)的燃烧热是H=-285.8kJ/mol,则2H2O(l)=2H2(g)+O2(g) H=+285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g)C(g)
(1)若开始时放入1mol A和1mol B,达到平衡后,生成a mol C,这时A的物质的量为_____ mol。
(2)若开始时放入3mol A和3mol B,达到平衡后,生成C的物质的量为_____mol。
(3)若开始时放入x mol A、2mol B和1mol C,达到平衡后,A和C的物质的量分别为y mol和3a mol,则x=_____,y=_____。
(4)若在(3)的平衡混合物中再加入3mol C,待再次达到平衡后,C的物质的量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 正戊烷、新戊烷、异戊烷互为同分异构体
B. 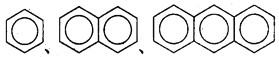 互为同系物
互为同系物
C. 四氯乙烯分子中所有原子都处于同一平面
D. 扁桃酸(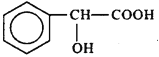 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种
)属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1NaOH溶液。
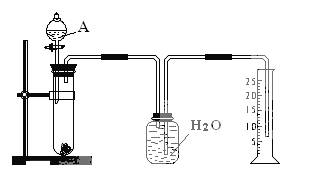
请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_________________________________________。
(2)A溶液可选用________________________________________
(3)若实验中测得样品的质量为W g ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是

A. 生成1 mol C5 H12至少需要4 mol H2
B. 该分子中所有碳原子在同一平面内
C. 三氯代物只有一种
D. 与其互为同分异构体,且只含碳碳三键的链烃有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com