
ЁОЬтФПЁПФГЭЌбЇЩшМЦСЫвЛИіМђЕЅЕФЪЕбщЃЈШчЭМЫљЪОЃЉЃЌвдВтЖЈУОТСКЯН№жаТСЕФжЪСПЗжЪ§ЁЃПЩЙЉбЁгУЕФЪдМСгаЃКХЈH2SO4ЁЂХЈЯѕЫсЁЂ6 molЁЄl-1NaOHШмвКЁЃ
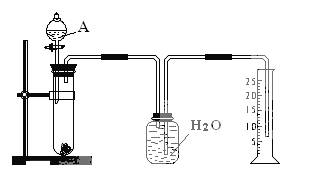
ЧыЬюаДЯТСаПеАзЃК
ЃЈ1ЃЉгаЙиЪЕбщВйзїЃКaЁЂЭљЪдЙмжаЗХШыЪЪСПЕФТСКЯН№бљЦЗЃЛbЁЂДгЗжвКТЉЖЗЭљЪдЙмжаМгШыЙ§СПЕФAШмвКЃЛcЁЂМьВщзАжУЕФЦјУмадЃЛdЁЂВтЖЈЪеМЏЕНЕФЫЎЕФЬхЛ§ЁЃ
е§ШЗЕФВйзїЫГађЮЊ_________________________________________ЁЃ
ЃЈ2ЃЉAШмвКПЩбЁгУ________________________________________
ЃЈ3ЃЉШєЪЕбщжаВтЕУбљЦЗЕФжЪСПЮЊW g ЃЌЧтЦјЕФЬхЛ§ЮЊa LЃЈБъзМзДПіЃЉЃЌдђбљЦЗжаAlЕФжЪСПЗжЪ§ЮЊ_______________________________________ЁЃ
ЁОД№АИЁПcabd 6molЁЄl-1NaOHШмвК 9a/11.2wЁС100%
ЁОНтЮіЁП
гУХХЫЎЗЈЪеМЏЦјЬх,ЪЕбщЪЧЭЈЙ§ВтЖЈЩњГЩЧтЦјЕФЬхЛ§,ИљОнМЦЫуШЗЖЈКЯН№жаAlЕФжЪСПЗжЪ§,
(1)ЪеМЏЦјЬхЕФЬхЛ§,МгШывЉЦЗЧАЯШМьбщзАжУЕФЦјУмад,ШЛКѓМгШШН№ЪєКЯН№,дйМгШыЧтбѕЛЏФЦШмвК,ВтЖЈЪеМЏЕНЕФЫЎЕФЬхЛ§ШЗЖЈЩњГЩЧтЦјЕФЬхЛ§ЃЛ
(2)гУХХЫЎЗЈЪеМЏЦјЬх,ЪЕбщЪЧЭЈЙ§ВтЖЈЩњГЩЧтЦјЕФЬхЛ§ЃЛ
(3)ИљОнЩњГЩЧтЦјЕФЬхЛ§МЦЫуКЯН№жаAlЕФжЪСП,НјЖјМЦЫуКЯН№жаAlЕФжЪСПЗжЪ§ЁЃ
гУХХЫЎЗЈЪеМЏЦјЬх,ЪЕбщЪЧЭЈЙ§ВтЖЈЩњГЩЧтЦјЕФЬхЛ§,ИљОнМЦЫуШЗЖЈКЯН№жаAlЕФжЪСПЗжЪ§,
(1)ЪеМЏЦјЬхЕФЬхЛ§,МгШывЉЦЗЧАЯШМьбщзАжУЕФЦјУмад,ШЛКѓМгШШН№ЪєКЯН№,дйМгШыЧтбѕЛЏФЦШмвК,ВтЖЈЪеМЏЕНЕФЫЎЕФЬхЛ§ШЗЖЈЩњГЩЧтЦјЕФЬхЛ§,ЙЪе§ШЗЕФВйзїЫГађЮЊcabd,
Д№АИЪЧ:cabdЃЛ
(2)гУХХЫЎЗЈЪеМЏЦјЬх,ЪЕбщЪЧЭЈЙ§ВтЖЈЩњГЩЧтЦјЕФЬхЛ§,ЙЪAжаЪдМСЮЊ6molЁЄl-1NaOHШмвКЃЛ
Д№АИЪЧ: 6molЁЄl-1NaOHШмвКЃЛ
(3)ЪЕбщжаВтЕУбљЦЗЕФжЪСПЮЊWg,ЧтЦјЕФЬхЛ§ЮЊaL(БъзМзДПі),дђ:
2Al+2NaOH+2H2OЈT2NaAlO2+3H2Ёќ
54g 3ЁС22.4
m(Al) aL
Ыљвдm(Al)=54ЁСa/3ЁС22.4=18a/22.4gЃЛЙЪКЯН№жаAlЕФжЪСПЗжЪ§=18a/22.4wЁС100%=9a/11.2wЁС100%ЃЛ
Д№АИЪЧ: 9a/11.2wЁС100%ЁЃ


 ЧсЧЩЖсЙкжмВтдТПМжБЭЈУћаЃЯЕСаД№АИ
ЧсЧЩЖсЙкжмВтдТПМжБЭЈУћаЃЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЭЌбЇзщзАСЫШчЭМЫљЪОЕФЕчЛЏбЇзАжУЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A.ЭМжаМзГиЮЊдЕчГизАжУЃЌCuЕчМЋЗЂЩњЛЙдЗДгІ
B.ЪЕбщЙ§ГЬжаЃЌМзГизѓВрЩеБжаNO3-ЕФХЈЖШВЛБф
C.ШєМзГижаAgЕчМЋжЪСПдіМг5.4gЪБЃЌввГиФГЕчМЋЮіГі1.6gН№ЪєЃЌдђввжаЕФФГбЮШмвКПЩФмЪЧAgNO3ШмвК
D.ШєгУЭжЦUаЮЮяДњЬцЁАбЮЧХЁБЃЌЙЄзївЛЖЮЪБМфКѓШЁГіUаЭЮяГЦСПЃЌжЪСПВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫцзХВФСЯПЦбЇЕФЗЂеЙЃЌН№ЪєЗАМАЦфЛЏКЯЮяЕУЕНСЫдНРДдНЙуЗКЕФгІгУЃЌВЂБЛгўЮЊЁАКЯН№ЕФЮЌЩњЫиЁБЁЃЮЊЛиЪеРћгУКЌЗАДпЛЏМСЃЈКЌгаV2O5ЁЂVOSO4МАВЛШмадВадќЃЉЃЌПЦбаШЫдБзюаТбажЦСЫвЛжжРызгНЛЛЛЗЈЛиЪеЗАЕФаТЙЄвеЃЌЛиЪеТЪДя91.7%вдЩЯЁЃВПЗжКЌЗАЮяжЪдкЫЎжаЕФШмНтадШчЯТБэЫљЪОЃК
ЮяжЪ | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
ШмНтад | ПЩШм | ФбШм | ФбШм | взШм |
ИУЙЄвеЕФжївЊСїГЬШчЯТЁЃ

ЧыЛиД№ЯТСаЮЪЬтЃК
ОЙ§ШШжиЗжЮіВтЕУЃКNH4VO3дкБКЩеЙ§ГЬжаЃЌЙЬЬхжЪСПЕФМѕЩйжЕЃЈзнзјБъЃЉЫцЮТЖШБфЛЏЕФЧњЯпШчЭМЫљЪОЁЃдђNH4VO3дкЗжНтЙ§ГЬжа_________ЁЃ

AЃЎЯШЗжНтЪЇШЅH2OЃЌдйЗжНтЪЇШЅNH3 BЃЎЯШЗжНтЪЇШЅNH3ЃЌдйЗжНтЪЇШЅH2O
CЃЎЭЌЪБЗжНтЪЇШЅH2OКЭNH3 DЃЎЭЌЪБЗжНтЪЇШЅH2ЁЂN2КЭH2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯжЦБИБћЯЉЕФЗНЗЈгаЖржжЃЌОпЬхШчЯТЃЈБОЬтБћЯЉгУC3H6БэЪОЃЉЃК
вбжЊt1minЪБДяЕНЦНКтзДЬЌЃЌВтЕУДЫЪБШнЦїжаn(C4H8)=mmolЃЌn(C2H4)=2mmolЃЌn(C3H6)=nmolЃЌЧвЦНКтЪБC3H6ЕФЬхЛ§ЗжЪ§ЮЊ![]() ЁЃ
ЁЃ
ЂйИУЪБМфЖЮФкЕФЗДгІЫйТЪv(C4H8)= _______mol/(LЁЄmin)ЁЃЃЈгУжЛКЌmЁЂVЁЂt1ЕФЪНзгБэЪОЃЉЁЃ
ЂкДЫЗДгІЕФЦНКтГЃЪ§K=______________ЁЃ
Ђлt1minЪБдйЭљШнЦїФкЭЈШыЕШЮяжЪЕФСПЕФC4H8КЭC2H4ЃЌдкаТЦНКтжаC3H6ЕФЬхЛ§ЗжЪ§_______![]() (ЬюЁА>ЁБЁА<ЁБЁА=ЁБ)ЁЃ
(ЬюЁА>ЁБЁА<ЁБЁА=ЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉСзЪЧЕиПЧжаКЌСПНЯЮЊЗсИЛЕФЗЧН№ЪєдЊЫиЃЌжївЊвдФбШмгкЫЎЕФСзЫсбЮШчCa3ЃЈPO4ЃЉ2ЕШаЮЪНДцдкЁЃЫќЕФЕЅжЪКЭЛЏКЯЮядкЙЄХЉвЕЩњВњжагазХживЊЕФгІгУЁЃ
АзСзЃЈP4ЃЉПЩгЩCa3ЃЈPO4ЃЉ2ЁЂНЙЬПКЭSiO2дквЛЖЈЬѕМўЯТЗДгІЛёЕУЁЃЯрЙиШШЛЏбЇЗНГЬЪНШчЯТЃК
2Ca3ЃЈPO4ЃЉ2ЃЈsЃЉ+10CЃЈsЃЉЈT6CaOЃЈsЃЉ+P4ЃЈsЃЉ+10COЃЈgЃЉЁїH1ЃН+3359.26 kJmolЉ1
CaOЃЈsЃЉ+SiO2ЃЈsЃЉЈTCaSiO3ЃЈsЃЉЁїH2ЃНЉ89.61 kJmolЉ1
аДГіАзСзЃЈP4ЃЉгЩCa3ЃЈPO4ЃЉ2ЁЂНЙЬПКЭSiO2дквЛЖЈЬѕМўЯТЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊЃК_____ЁЃ
ЃЈ2ЃЉЕчзгЙЄвЕжаЧхЯДЙшЦЌЩЯЕФSiO2ЃЈsЃЉЕФЗДгІЮЊSiO2ЃЈsЃЉ+4HFЃЈgЃЉЈTSiF4ЃЈgЃЉ+2H2OЃЈgЃЉЁїHЃЈ298.15 KЃЉЃНЉ94.0 kJmolЉ1ЁїSЃЈ298.15 KЃЉЃНЉ75.8 JmolЉ1KЉ1ЃЌЩшЁїHКЭЁїSВЛЫцЮТЖШЖјБфЛЏЃЌДЫЗДгІздЗЂНјааЕФЮТЖШЪЧ_____
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкЗжзгЪНЮЊC4H8O2ЕФгаЛњЮяЕФЭЌЗжвьЙЙЬхЕФЫЕЗЈжаЃЌВЛе§ШЗЕФЪЧ( )
A. ЪєгкѕЅРрЕФга4жж
B. ЪєгкєШЫсРрЕФга2жж
C. МШКЌгаєЧЛљгжКЌгаШЉЛљЕФга3жж
D. ДцдкЗжзгжаКЌгаСљдЊЛЗЕФЭЌЗжвьЙЙЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
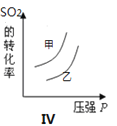
ЁОЬтФПЁПдкШнЛ§ВЛБфЕФУмБеШнЦїжаДцдкШчЯТЗДгІ2SO2(g)ЃЋO2(g) ![]() 2SO3(g) ІЄH ЃМ0ЃЌФГбЇЯАаЁзщбаОПСЫЦфЫћЬѕМўВЛБфЪБЃЌИФБфФГвЛЬѕМўЖдЩЯЪіЗДгІЕФгАЯьЃЌЯТСаЗжЮіе§ШЗЕФЪЧ ( )
2SO3(g) ІЄH ЃМ0ЃЌФГбЇЯАаЁзщбаОПСЫЦфЫћЬѕМўВЛБфЪБЃЌИФБфФГвЛЬѕМўЖдЩЯЪіЗДгІЕФгАЯьЃЌЯТСаЗжЮіе§ШЗЕФЪЧ ( )
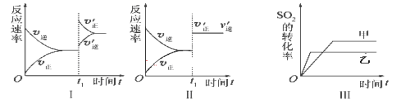
A.ЭМЂёБэЪОЕФЪЧt1ЪБПЬдіДѓO2ЕФХЈЖШЖдЗДгІЫйТЪЕФгАЯь
B.ЭМЂђБэЪОЕФЪЧt1ЪБПЬМгШыДпЛЏМСКѓЖдЗДгІЫйТЪЕФгАЯь
C.ЭМЂѓБэЪОЕФЪЧбЙЧПЖдЛЏбЇЦНКтЕФгАЯьЃЌЧвввЕФбЙЧПНЯИп
D.ЭМIVБэЪОЕФЪЧЮТЖШЁЂбЙЧПЖдЦНКтЕФгАЯьЃЌЧвМзЕФЮТЖШБШввЕФИп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБъзМзДПіЯТЃЌЯђ2molЁЄL-1ЕФNaOHШмвК100mLжаЛКЛКЭЈШы4.48LCO2ЦјЬхЃЌГфЗжЗДгІКѓШмвКжаРызгХЈЖШДѓаЁХХСаЫГађе§ШЗЕФЪЧ
A.c(Na+)ЃОc(![]() )ЃОc(OHЃ)ЃОc(H+)B.c(Na+)+ c(H+)=c(
)ЃОc(OHЃ)ЃОc(H+)B.c(Na+)+ c(H+)=c(![]() )+ c(OHЃ)
)+ c(OHЃ)
C.c(Na+)ЃОc(![]() )ЃОc(H+)ЃОc(OHЃ)D.c(Na+)=c(
)ЃОc(H+)ЃОc(OHЃ)D.c(Na+)=c(![]() )ЃОc(OHЃ)ЃОc(H+)
)ЃОc(OHЃ)ЃОc(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЯТЃЌНЋ2 mol AКЭ1 mol BЗХШывЛУмБеШнЦїжаЃЌЗЂЩњЗДгІЃКA(g)ЃЋB(g)![]() 2C(s)ЃЋ2D(g)ЃЌ5 minКѓЗДгІДяЕНЦНКтЃЌВтЕУЩњГЩCЮЊ0ЃЎ8 molЃЌЯТСаЯрЙиБэЪіе§ШЗЕФЪЧ
2C(s)ЃЋ2D(g)ЃЌ5 minКѓЗДгІДяЕНЦНКтЃЌВтЕУЩњГЩCЮЊ0ЃЎ8 molЃЌЯТСаЯрЙиБэЪіе§ШЗЕФЪЧ
A.ИУЗДгІЕФЛЏбЇЦНКтГЃЪ§БэДяЪНЪЧKЃН![]()
B.ИУЬѕМўЯТBЕФЦНКтзЊЛЏТЪЪЧ40%
C.діДѓИУЬхЯЕЕФбЙЧПЃЌAЕФзЊЛЏТЪдіДѓ
D.ШєЯђЦНКтЬхЯЕжаМгШыЩйСПЩњГЩЮяCЃЌдђе§ЁЂФцЗДгІЫйТЪОљдіДѓ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com