
����Ŀ�����Ų��Ͽ�ѧ�ķ�չ�����������仯����õ���Խ��Խ�㷺��Ӧ�ã�������Ϊ���Ͻ��ά��������Ϊ�������ú�������������V2O5��VOSO4�������Բ�������������Ա����������һ�����ӽ��������շ����¹��գ������ʴ�91.7%���ϡ����ֺ���������ˮ�е��ܽ������±���ʾ��
���� | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
�ܽ��� | ���� | ���� | ���� | ���� |
�ù��յ���Ҫ�������¡�

��ش��������⣺
�������ط�����ã�NH4VO3�ڱ��չ����У����������ļ���ֵ�������꣩���¶ȱ仯��������ͼ��ʾ����NH4VO3�ڷֽ������_________��

A���ȷֽ�ʧȥH2O���ٷֽ�ʧȥNH3 B���ȷֽ�ʧȥNH3���ٷֽ�ʧȥH2O
C��ͬʱ�ֽ�ʧȥH2O��NH3 D��ͬʱ�ֽ�ʧȥH2��N2��H2O
���𰸡�B
��������
����NH4VO3�ڱ��ձ仯��ͼ���й�������������Ϸ���ʽ������
����NH4VO3�ڱ��ձ仯��ͼ���֪��
![]()
210��ʱ��������������ֵΪ1-85.47%=14.54%��380��ʱ��������������ֵΪ85.47-77.78%=7.69%�����ݷ���ʽ֪������ˮʱ�����������ٷ���С�����ɰ���ʱ�����������ٷ���������210��ʱ���ٵ��ǰ�����380��ʱ���ٵ���ˮ����÷�Ӧ��������ʧȥ������ʧȥˮ���ʴ�ѡB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��������ˮ��Һ�е�ƽ�����˽����Ĵ�����ʽ��
(1)�����£���100mL0.01molL-1HA����Һ����μ���0.02molL-1MOH��Һ��������Һ��pH��MOH��Һ������仯��ͼ��ʾ����Һ����仯���Բ��ƣ���

�ٳ����£�0.01molL-1HA��Һ����ˮ�������c��H+��=______molL-1��
�ڳ�����һ��Ũ�ȵ�MAϡ��Һ��pH=a����a__7�����������������=�����������ӷ���ʽ��ʾ��ԭ��Ϊ_______________________________________��
��X��ʱ����Һ��c��H+����c��M+����c��A�����ɴ�С��˳����___________________��
��K��ʱ����Һ��c��H+��+c��M+����c��OH����=____molL-1��
��20��ʱ����c��H2C2O4��+c��HC2O4����+c��C2O42����=0.100molL��1��H2C2O4��NaOH�����Һ�У�H2C2O4��HC2O4-��C2O42-�����ʵ�������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ��

��Q�㣺c��H2C2O4��______c��HC2O4���������������������=����
�ڸ��¶���HC2O4-�ĵ��볣��K=___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£��ı䷴Ӧ����n(SO2)���Է�Ӧ2SO2(g)+O2(g)2SO3(g) ��H<0��Ӱ����ͼ��ʾ������˵����ȷ���ǣ� ��
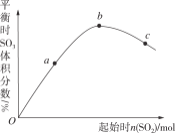
A.��Ӧbc���Ϊƽ��㣬a��δ�ﵽƽ����������Ӧ�������
B.abc�����ƽ�ⳣ��Kb>Kc>Ka
C.����ͼ����Եó�SO2�ĺ���Խ�ߵõ��Ļ��������SO3���������Խ��
D.abc�����У�a��ʱSO2��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ���ڻ���������Ҳ��ֱ������ȼ�ϡ���֪��
CH3OH(l)+O2(g)![]() CO(g)+2H2O(g)
CO(g)+2H2O(g)![]() ��
��
2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)![]() ��
��
����˵�����Ȼ�ѧ����ʽ��ȷ����
A.CO��ȼ����Ϊ![]()
B.2 mol CO��1 mol O2����������2 mol CO2����������
C.2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g)
2CO2(g)+4H2O(g)![]()
D.��ȫȼ��16g�״�������һ����̼��ˮʱ�ų�������Ϊ221.82 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T ��ʱ��������(Ag2CrO4)��ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ������˵���в���ȷ���ǣ� ��

A.T ��ʱ����Y���Z�㣬Ag2CrO4��Ksp���
B.a��![]() ��10��5
��10��5
C.T ��ʱ��Ag2CrO4��KspΪ1��10��11
D.��Ag2CrO4��Һ�м������K2CrO4����ʹ��Һ��Y���ΪX��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ��������ȷ����
A.��˹����ʵ�����������غ㶨�ɵ�����
B.�ڼ��������½��еķ�Ӧ��һ�������ȷ�Ӧ
C.��3O2(g)=2O3(g)H=+284.2kJ/mol����֪O2��O3�ȶ�
D.��֪��H2(g)��ȼ������H=-285.8kJ/mol����2H2O(l)=2H2(g)+O2(g) H=+285.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¡���ѹ�£���һ���ݻ��ɱ�������з������·�Ӧ��A��g��+B��g��C��g��
��1������ʼʱ����1mol A��1mol B���ﵽƽ�������a mol C����ʱA�����ʵ���Ϊ_____ mol��
��2������ʼʱ����3mol A��3mol B���ﵽƽ�������C�����ʵ���Ϊ_____mol��
��3������ʼʱ����x mol A��2mol B��1mol C���ﵽƽ���A��C�����ʵ����ֱ�Ϊy mol��3a mol����x��_____��y��_____��
��4�����ڣ�3����ƽ���������ټ���3mol C�����ٴδﵽƽ���C�����ʵ���������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����һ����ʵ�飨��ͼ��ʾ�����Բⶨþ���Ͻ������������������ɹ�ѡ�õ��Լ��У�ŨH2SO4��Ũ���ᡢ6 mol��l-1NaOH��Һ��
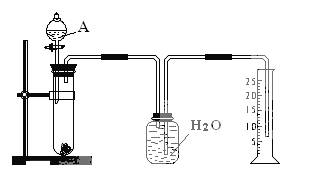
����д���пհף�
��1���й�ʵ�������a�����Թ��з������������Ͻ���Ʒ��b���ӷ�Һ©�����Թ��м��������A��Һ��c�����װ�õ������ԣ�d���ⶨ�ռ�����ˮ�������
��ȷ�IJ���˳��Ϊ_________________________________________��
��2��A��Һ��ѡ��________________________________________
��3����ʵ���в����Ʒ������ΪW g �����������Ϊa L����״����������Ʒ��Al����������Ϊ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1��105 Pa��298 K�����£�2 mol����ȼ������ˮ�����ų�484 kJ�����������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.2H2(g)��O2(g)===2H2O(g) ��H����484 kJ��mol��1
B.H2O(g)===H2(g)��1/2O2(g) ��H����242 kJ��mol��1
C.H2(g)��1/2O2(g)===H2O(g) ��H����242 kJ��mol��1
D.2H2(g)��O2(g)===2H2O(l) ��H����484 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com