
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
B.H2O(g)===H2(g)+1/2O2(g) ΔH=+242 kJ·mol-1
C.H2(g)+1/2O2(g)===H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
该工艺的主要流程如下。

请回答下列问题:
经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。

A.先分解失去H2O,再分解失去NH3 B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3 D.同时分解失去H2、N2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0,某学习小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
2SO3(g) ΔH <0,某学习小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
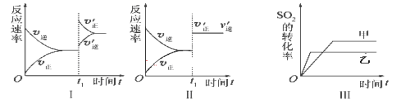
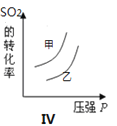
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
D.图IV表示的是温度、压强对平衡的影响,且甲的温度比乙的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向2mol·L-1的NaOH溶液100mL中缓缓通入4.48LCO2气体,充分反应后溶液中离子浓度大小排列顺序正确的是
A.c(Na+)>c(![]() )>c(OH-)>c(H+)B.c(Na+)+ c(H+)=c(
)>c(OH-)>c(H+)B.c(Na+)+ c(H+)=c(![]() )+ c(OH-)
)+ c(OH-)
C.c(Na+)>c(![]() )>c(H+)>c(OH-)D.c(Na+)=c(
)>c(H+)>c(OH-)D.c(Na+)=c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醇在浓硫酸作用下迅速加热到170 ℃时分子内脱水可制备乙烯,反应如下:

加热到140 ℃时产生一种副产物乙醚.反应装置如图所示,试回答下列问题:

(1)检查装置气密性的方法是________________,A仪器的名称是________.
(2)A中加入试剂的顺序是_____________________,A中加入碎瓷片的作用是___________.
(3)反应中除产生副产物乙醚外,在收集到的乙烯气体中混有SO2,设计实验除去SO2:___________.
(4)乙烯能被酸性高锰酸钾溶液氧化成甲酸(HCOOH),写出反应的化学方程式:__________________;若反应中有0.42 g乙烯被氧化,则反应中转移电子的数目为_____________________________.
(5)乙烯在农业生产实践中的应用是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴甲苯、2-溴甲苯以及HBr都是重要的有机中间体。以甲苯、液溴、铁粉、水为原料生产上述物质的实验步骤如下:

步骤1:在三颈烧瓶中(装置如图所示)加入0.3g铁粉,46g甲苯和60 mL水,在分液漏斗中加入80 g液溴,再加入10 mL水。
步骤2:打开分液漏斗滴加液溴,不断搅拌保持反应温度在20~25℃之间。最后将分液漏斗中的水也全部加入三颈烧瓶中,继续搅拌0.5h,即可反应完全。
步骤3:移走冷水浴装置,加热三颈烧瓶至反应温度在122~126℃,馏出液进入分水器中,打开分水器阀门将下层液体仍加入三颈烧瓶中,上层液体倒入烧杯中。
步骤4:将三颈烧瓶中液体进行处理,分离出4-溴甲苯和2-溴甲苯,两者的总产量为51.3g。
回答下列问题:
(1)实验中液溴的滴加方式是__________;在分液漏斗中加入80g液溴,再加入10mL水的目的是_________。
(2)冷凝水应从冷凝管的________(a或b)端进入;实验中发现分水器中的液体出现回流,应采取操作是_____________________。
(3)写出反应装置中生成4-溴甲苯的化学方程式:_________。分离出4-溴甲苯和2-溴甲苯,应采用的操作是___________。
(4)该实验装置中还缺少的必要实验仪器是____________。
(5)反应温度保持在20~25℃之间,其原因是__________。
(6)本实验中,一溴甲苯(4-溴甲苯和2-溴甲苯)的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g)![]() 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K=![]()
B.该条件下B的平衡转化率是40%
C.增大该体系的压强,A的转化率增大
D.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;常温下H2C2O4为晶体,易溶于水,溶解度随温度升高而增大。

请回答:
(1)步骤②,发生反应的离子方程式____________________________;该步骤H2C2O4稍过量主要是为了_________________。
(2)下列操作或描述正确的是_______________。
A.步骤①,酸化主要是为了抑制Fe2+水解
B.步骤③,如果采用冷水洗涤可提高除杂效果
C.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n(C2O42-)·mol-1 | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.98 |
由表中数据推测试样中最主要的杂质是_________________。
(4)实现步骤④必须用到的两种仪器是_________(供选仪器如下)
a.坩埚;b.烧杯;c.蒸馏烧瓶;d.锥形瓶;e.表面皿:f.高温炉
该步骤的化学方程式是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com