
【题目】下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在加热条件下进行的反应不一定是吸热反应
C.由3O2(g)=2O3(g)H=+284.2kJ/mol,可知O2比O3稳定
D.已知,H2(g)的燃烧热是H=-285.8kJ/mol,则2H2O(l)=2H2(g)+O2(g) H=+285.8kJ/mol
【答案】D
【解析】
A.盖斯定律的内容:化学反应不管是一步还是几步完成,其反应的焓变是一定值,反应物和生成物确定,其能量是一定的,所以焓变是不变的,实质上是能量守恒定律的体现,A说法正确;
B.有的放热反应需要加热才发生,如铝热反应是放热反应,但需要加热,B说法正确;
C.由3O2(g)=2O3(g)H=+284.2kJ/mol,可知O2比O3能量低,即O2比O3稳定,C说法正确;
D.氢气的燃烧是H=-285.8kJ/mol,其燃烧的热化学方程式为:H2(g)+![]() O2(g) = H2O(l) H=-285.8kJ/mol,则H2O(l)=H2(g)+
O2(g) = H2O(l) H=-285.8kJ/mol,则H2O(l)=H2(g)+![]() O2(g) H=+285.8kJ/mol,D说法错误;
O2(g) H=+285.8kJ/mol,D说法错误;
故选:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mo/L、0.15mol/L,则此时v正________v逆(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是

A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用下图所示装置进行实验。以探究苯与溴发生反应的原理并分离提纯反应的产物。

请回答下列问题:
(1)写出装置Ⅱ中发生的主要化学反应方程式____________________________,其中冷凝管所起的作用为导气和________,Ⅳ中球形干燥管的作用是__________。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。Ⅲ中小试管内苯的作用是_________________________。
(3)能说明苯与液溴发生了取代反应的现象是______________________。
(4)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中以除去装置Ⅱ中残余的HBr气体。简述如何实现这一操作:______________________________________。
(5)纯净的溴苯是无色油状的液体,这个装置制得的溴苯呈红棕色,原因是里面混有______________,将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。①用蒸馏水洗涤,振荡,分液;②用__________洗涤,振荡,分液;③蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是__________________(填字母)。
a.![]() b.
b.![]() c.
c.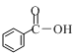
② 下列物质分子中所有原子处于同一平面的是__________________(填字母)。
a.苯 b.丙烯 c.甲醇
(2)乙烯使溴水或溴的四氯化碳溶液褪色的化学方程式:_____________________
(3)乙醇的催化氧化反应的化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应M(g)+N(g) ![]() P (g)+Q(g) ,请回答下列问题:
P (g)+Q(g) ,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 molL-1,c(N)=2.4 molL-1,达到平衡后,M的转化率为60%,此时N的转化率为__________ ;该温度时K=_________。
(2)若温度升高K值增大,则该反应为______反应。(填“吸热”或“放热”)。理由_________________。
(3)若反应温度升高,M的转化率______(填“增大”“减小”或“不变”;)
(4)若反应温度不变,反应物的起始浓度分别为:c(M)= 4molL-1, c(N)=a molL-1;达到平衡后,c(P)=2 molL-1,a=________。
(5)若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b molL-1,达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示。下列说法正确的是( )

A.溶液中的氢离子浓度:a<b
B.盐酸的物质的量浓度为0.0100mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00mL时(忽略反应前后体积变化),该混合液的pH=1+lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液 ②NaHCO3溶液 ③NH4Cl溶液 ④NaOH溶液
(1)这4种溶液pH由大到小的排列顺序是______________(填序号),其中由水电离出的H+浓度最小的是______________(填序号)。
(2)该温度下②中NaHCO3的水解平衡常数Kh=______________mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)该温度下向③中通入少量氨气,此时c(NH4+): c(NH3·H2O)的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积___④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法。某研究性学习小组将下列装置如图连接,D、E、X、Y都是铂电极、C、F是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)B极的名称是___。
(2)甲装置中电解反应的总化学方程式是:___。
(3)设电解质溶液过量,电解后乙池中加入___(填物质名称)可以使溶液复原。
(4)设甲池中溶液的体积在电解前后都是500ml,乙池中溶液的体积在电解前后都是200mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为___mol/L;乙池中溶液的pH=___;
(5)装置丁中的现象是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com