
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是__________________(填字母)。
a.![]() b.
b.![]() c.
c.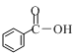
② 下列物质分子中所有原子处于同一平面的是__________________(填字母)。
a.苯 b.丙烯 c.甲醇
(2)乙烯使溴水或溴的四氯化碳溶液褪色的化学方程式:_____________________
(3)乙醇的催化氧化反应的化学方程式:___________________________
【答案】c a CH2=CH2+Br2→CH2Br-CH2Br 2C2H5OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
(1)根据常见官能团的结构判断;熟悉典型的平面结构;
(2)(3)熟悉一些常见反应的化学方程式;
(1)①羧基的结构简式为:-COOH;故答案为:c;
②苯是平面型结构,所有原子都处于同一平面内;丙烯含有甲基,具有甲烷的结构特点,所有原子不可能在同一个平面上;甲醇含有甲基,具有甲烷的结构特点,所有原子不可能在同一个平面上,故答案为:a;
(2)乙烯使溴水褪色,乙烯与溴发生加成反应生成1,2-二溴乙烷,其反应的方程式为:CH2=CH2+Br2→CH2Br-CH2Br;故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
(3)乙醇催化氧化生成乙醛,反应为2C2H5OH+O2![]() 2CH3CHO+2H2O,故答案为:2C2H5OH+O2
2CH3CHO+2H2O,故答案为:2C2H5OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为__________________。
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7,离子浓度大小关系_______。
(3)pH=2的CH3COOH与pH=12的NaOH等体积混合,离子浓度大小关系______。
(4)将标准状况下2.24LCO2缓慢通入1L0.15mol·L-1的NaOH溶液中,气体被充分吸收,离子浓度大小关系________。
(5)通过 本题的解答,总结若要比较溶液中离子浓度大小顺序,应先确定_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-丁烯是一种重要的有机化工原料。回答下列问题:
(1)已知2-丁烯有顺、反两种同分异构体,可表示为顺![]() 、反
、反![]() 。一定条件下,它们分别发生加成反应的热化学方程式为:
。一定条件下,它们分别发生加成反应的热化学方程式为:
①顺![]() :
:
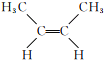
![]() 。
。
②反![]() :
:
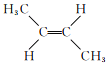
![]()
相同条件下,两种气体之间存在如下转化:
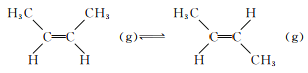
该反应的△H=________。下列叙述中,能表明该反应已达到平衡状态的是________(填序号)。
a.顺-C4H8的含量保持不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反-C4H8的含量,可采取的措施是___________________________。
(2)2-丁烯与氯气反应时,一般用镍作催化剂。镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料。
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(s)+4CO(g) ![]() Ni(CO)4(g) △H<0
Ni(CO)4(g) △H<0
Ⅱ.Ni(CO)4(g) ![]() Ni(s)+4CO(g)
Ni(s)+4CO(g)
则下图中能反映出羰基法提纯粗镍过程中能量变化的是________。

②一定条件下,在2L密闭容器中制备Ni(CO)4,粗镍(所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为________mol/(L·min)。
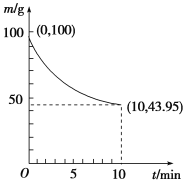
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时________(填序号)。
a.平衡常数K增大 b.CO的浓度减小 c.v逆[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍:将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一直反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)a、b、c、d、e中属于平衡状态的是_____________,100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20~40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变
B. 恒容条件下,气体的额密度不变
C. 2v正(NO2)=v逆(N2O4)/p>
D. 混合气体的平均摩尔质量不变
(5)100℃时,容器中物质的量的变化曲线如图,请画出80℃时物质的量的变化曲线并进行适当标注。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某有机物结构如图所示,  它的结构最多有_______种
它的结构最多有_______种
II.已知:苯的同系物中,与苯环直接相连的碳原子上有氢原子,就能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:

现有苯的同系物甲、乙、丙,分子式都是C10H14,完成以下空格:
(1)甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是 ______________________;
(2)乙能被酸性高锰酸钾溶液氧化成分子式为C9H6O6的芳香酸,则乙可能的结构有 ___种。
(3)丙苯环上的一溴代物只有一种。试写出丙可能的结构简式(写至少2种)____________________、______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是
A.盖斯定律实质上是能量守恒定律的体现
B.在加热条件下进行的反应不一定是吸热反应
C.由3O2(g)=2O3(g)H=+284.2kJ/mol,可知O2比O3稳定
D.已知,H2(g)的燃烧热是H=-285.8kJ/mol,则2H2O(l)=2H2(g)+O2(g) H=+285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,b为阴极。同时a、d电极上产生气泡。试回答

(1)a连接电源的___极。b极的电极反应式为______。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:___________。此时C极上的电极反应式为:_________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上的电极反应式为___________,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 ______ 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO和CO2的应用对构建低碳、环保的生态文明型社会具有重要的意义。以CO和H2为原料可以制取甲醇。已知部分反应的热化学方程式如下:
反应Ⅰ CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99 kJ·mol-1
CH3OH(g) ΔH=-99 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(l) ΔH=-3 kJ·mol-1
CO(g)+H2O(l) ΔH=-3 kJ·mol-1
反应Ⅲ H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
CH3OH(g)+H2O(g)的ΔH=____kJ·mol-1。
(2)向T1℃的恒容密闭容器中充入一定量的CO和H2,发生反应Ⅰ,保持温度不变,测得CH3OH的物质的量随时间的变化关系如图所示。

①下列条件可以判定反应到达平衡状态的是____(填字母)。
A.2v正(H2)=v逆(CH3OH)
B.容器内气体的密度不变
C.容器内压强不变
D.反应不再释放热量
②在图中作出当其他条件不变,温度改为T2℃(T1<T2)时CH3OH的物质的量随时间的变化关系图。_____
(3)体积可变的密闭容器中,起始n(H2)/n(CO)=2.60时,反应Ⅰ体系中CO的平衡转化率(α)与温度和压强的关系如图所示。

①α(CO)随温度升高而减小的原因是____。
②图中压强p1、p2、p3中最大的是____。
③若起始CO、H2、CH3OH的物质的量分别为0 mol、1.2 mol、2 mol,保持温度为530K、压强为p2,反应达到平衡时,CH3OH的转化率是____。
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________(填“酸性”“中性”或“碱性”)。
(2)25℃时,将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=________,m与n的大小关系是m________n(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com