
【题目】下图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,b为阴极。同时a、d电极上产生气泡。试回答

(1)a连接电源的___极。b极的电极反应式为______。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:___________。此时C极上的电极反应式为:_________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上的电极反应式为___________,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 ______ 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为____________?
【答案】正 M++e-=M C电极周围先变蓝色 2I--2e-=I2 4OH--4e-=O2↑+2H2O 108g/mol 0.12mol/L
【解析】
因为b为阴极,故a为阳极,c为阳极,d为阴极;a极产生氧气,c极产生I2,d极产生氢气。
(1)因为b为阴极,故a为阳极,所以a连接电源正极;b极为阴极,发生还原反应生成M,电极反应式为:![]() ,
,
故答案为:正;![]() ;
;
(2)c为阳极,电极反应式为:![]() ,产生碘单质,淀粉遇碘变蓝色,
,产生碘单质,淀粉遇碘变蓝色,
故答案为:C电极周围先变蓝色;![]() ;
;
(3)a电极为阳极,氢氧根放电生成氧气,电极反应式为:![]() ,d极产生氢气,d极上收集到44.8mL气体即0.002mol氢气时,电路中流过0.004mol电子,b极生成金属M的物质的量为0.004mol,故金属M的摩尔质量为
,d极产生氢气,d极上收集到44.8mL气体即0.002mol氢气时,电路中流过0.004mol电子,b极生成金属M的物质的量为0.004mol,故金属M的摩尔质量为![]() ,
,
故答案为:108g/mol;
(4)根据摩尔质量可以推知M为银,银离子和氯离子会产生氯化银沉淀,根据题中“取该溶液逐滴滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全”可推知,电解停止后稀释所得硝酸银的浓度0.1mol/L, 电解消耗了0.004mol银离子,溶液体积为0.2L,所以原溶液浓度为:![]() ,
,
故答案为:0.12mol/L。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是
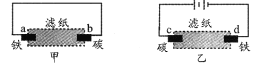
A. 甲是原电池,乙是电解池
B. 甲中铁棒比乙中铁棒更易腐蚀
C. d电极上的电极反应是:Fe-2e → Fe2+
D. b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生产聚苯乙烯的流程如下,下列叙述不正确的是

A.①是加成反应
B.乙苯和氢气加成后的产物的一氯代物有5种
C.鉴别乙苯与聚苯乙烯不可用Br2的四氯化碳溶液
D.乙烯和聚苯乙烯均可以和H2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是__________________(填字母)。
a.![]() b.
b.![]() c.
c.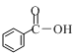
② 下列物质分子中所有原子处于同一平面的是__________________(填字母)。
a.苯 b.丙烯 c.甲醇
(2)乙烯使溴水或溴的四氯化碳溶液褪色的化学方程式:_____________________
(3)乙醇的催化氧化反应的化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
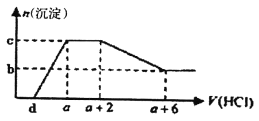
A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示。下列说法正确的是( )

A.溶液中的氢离子浓度:a<b
B.盐酸的物质的量浓度为0.0100mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00mL时(忽略反应前后体积变化),该混合液的pH=1+lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积相同的恒容密闭容器中发生反应:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
C(s) | H2O(g) | CO(g) | H2(g) | CO(g) | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0 | 0.4 |
Ⅱ | 500 | 0 | 0 | 2.0 | 2.0 | |
Ⅲ | 400 | 1.0 | 1.0 | 0 | 0 | 0.3 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,容器内的压强:2PⅠ<PⅡ
C.达到平衡时,反应物的转化率αⅠ(H2O)+αⅡ(CO)<1
D.若起始时向容器Ⅰ中加入2.7 mol C(s)、0.4mol H2O(g)、0.6mol CO(g)和0.6mol H2(g),则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2广泛应用于涂料、塑料、造纸、印刷油墨等领域。TiOSO4溶液加水稀释可析出aTiO2·bH2O沉淀。
(1)写出TiOSO4溶液加水稀释时所发生反应的化学方程式:____。
(2)实验室测定aTiO2·bH2O组成的方法如下:
步骤一:取样品4.900 g,在酸性条件下充分溶解,加入适量铝将溶解生成的TiO2+还原为Ti3+,将溶液转移到容量瓶中,并定容至250 mL。
步骤二:取25.00 mL定容后的溶液于锥形瓶中,加入KSCN溶液作指示剂,用0.2000mol·L-1的NH4Fe(SO4)2 标准溶液滴定,将实验数据记录在下表中。重复滴定2次。滴定过程发生的物质转化为:Ti3+![]() TiO2+
TiO2+
滴定序号 | 待测液体积/mL | NH4Fe(SO4)2标准溶液 | |
滴定管起点读数/mL | 滴定管终点读数/mL | ||
1 | 25.00 | 0.04 | 25.04 |
2 | 25.00 | 0.07 | 25.05 |
3 | 25.00 | 0.13 | 25.15 |
①使用滴定管过程中所涉及下列操作的先后顺序是____(填字母)。
a.排除滴定管尖嘴处的气泡 b.检查滴定管是否漏液 c.用待装液润洗滴定管
②滴定终点的实验现象是____。
③通过计算确定该样品的组成,写出计算过程____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图叙述正确的是![]()

A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,
发生反应过程中的能量变化,![]() 的燃烧热为
的燃烧热为![]()
B.乙表示恒温恒容条件下反应![]() 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
D.丁表示室温下,将![]() 盐酸滴入
盐酸滴入![]()
![]() 氨水中,溶液pH和温度随加入盐酸体积变化曲线
氨水中,溶液pH和温度随加入盐酸体积变化曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com