
【题目】用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是
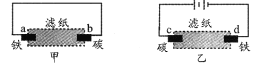
A. 甲是原电池,乙是电解池
B. 甲中铁棒比乙中铁棒更易腐蚀
C. d电极上的电极反应是:Fe-2e → Fe2+
D. b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是______ 。
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 用石墨电极电解 | 比较确定铜和镁的金属活动性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为__________________。
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7,离子浓度大小关系_______。
(3)pH=2的CH3COOH与pH=12的NaOH等体积混合,离子浓度大小关系______。
(4)将标准状况下2.24LCO2缓慢通入1L0.15mol·L-1的NaOH溶液中,气体被充分吸收,离子浓度大小关系________。
(5)通过 本题的解答,总结若要比较溶液中离子浓度大小顺序,应先确定_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可以达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验亚硫酸钠是否变质 | 先将亚硫酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入 |
B | 除去苯中混有的苯酚 | 加入适量的溴水,充分反应后过滤,弃去沉淀 |
C | 除去NaCl晶体中混有 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
D | 检验 | 将 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
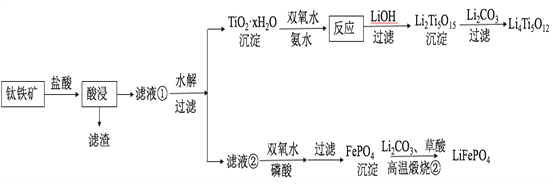
回答下列问题:
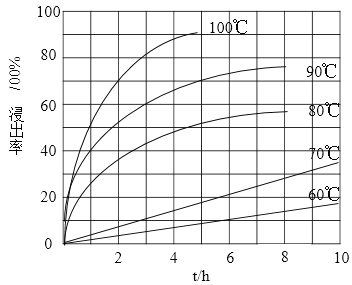
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在0.5 L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。则下列结论正确的是

A. 10 s时反应生成了0.2 mol C
B. 该反应进行到10 s时,消耗了0.2 molA
C. 该反应的化学方程式为3A+B![]() 2C
2C
D. 10 s内用B表示的反应速率为0.01 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
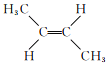
【题目】2-丁烯是一种重要的有机化工原料。回答下列问题:
(1)已知2-丁烯有顺、反两种同分异构体,可表示为顺![]() 、反
、反![]() 。一定条件下,它们分别发生加成反应的热化学方程式为:
。一定条件下,它们分别发生加成反应的热化学方程式为:
①顺![]() :
:
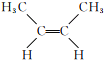
![]() 。
。
②反![]() :
:
![]()
相同条件下,两种气体之间存在如下转化:
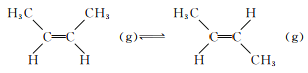
该反应的△H=________。下列叙述中,能表明该反应已达到平衡状态的是________(填序号)。
a.顺-C4H8的含量保持不变
b.混合气体的平均摩尔质量保持不变
c.混合气体中碳的质量分数保持不变
达到平衡后,若要进一步提高体系中反-C4H8的含量,可采取的措施是___________________________。
(2)2-丁烯与氯气反应时,一般用镍作催化剂。镍具有优良的物理和化学特性,是许多领域尤其是高科技产业的重要原料。
①羰基法提纯粗镍涉及的两步反应依次为:
Ⅰ.Ni(s)+4CO(g) ![]() Ni(CO)4(g) △H<0
Ni(CO)4(g) △H<0
Ⅱ.Ni(CO)4(g) ![]() Ni(s)+4CO(g)
Ni(s)+4CO(g)
则下图中能反映出羰基法提纯粗镍过程中能量变化的是________。

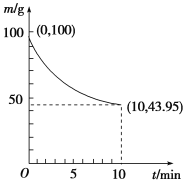
②一定条件下,在2L密闭容器中制备Ni(CO)4,粗镍(所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为________mol/(L·min)。
③若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时________(填序号)。
a.平衡常数K增大 b.CO的浓度减小 c.v逆[Ni(CO)4]增大
④设计简单实验方案用羰基法提纯粗镍:将粗镍粉末装入玻璃管一端,抽真空后充入CO并封管,______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,b为阴极。同时a、d电极上产生气泡。试回答

(1)a连接电源的___极。b极的电极反应式为______。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:___________。此时C极上的电极反应式为:_________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上的电极反应式为___________,若在b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 ______ 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL。取该溶液逐滴加入到25.0mL0.1mol/L HCl溶液中,当加入25.00mL这种溶液时刚好沉淀完全。试计算电解前A烧杯中MNO3溶液的物质的量浓度为____________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com