
����Ŀ���Ƚ����м�����Һ��Ϻ������Ũ�ȵĴ�С��
(1)CH3COOH��NaOH��Ũ�ȵ������ϣ�����Ũ�ȴ�С˳��Ϊ__________________��
(2)NaOH��CH3COOH��Ũ�Ȱ�1��2����Ȼ�Ϻ�pH<7������Ũ�ȴ�С��ϵ_______��
(3)pH��2��CH3COOH��pH��12��NaOH�������ϣ�����Ũ�ȴ�С��ϵ______��
(4)����״����2.24LCO2����ͨ��1L0.15mol��L��1��NaOH��Һ�У����屻������գ�����Ũ�ȴ�С��ϵ________��
(5)ͨ�� ����Ľ���ܽ���Ҫ�Ƚ���Һ������Ũ�ȴ�С˳��Ӧ��ȷ��_____��
���𰸡�c��Na������c��CH3COO������c��OH������c��H���� c��CH3COO������c��Na������c��H������c��OH���� c��CH3COO������c��Na������c��H������c��OH���� c��Na������c��HCO3������c��CO32������c��OH������c��H���� ����
��������
��1�����������Ũ�ȵ�CH3COOH��NaOH��Һ��ϣ���Ӧ������Ϊ�����ƣ���������Ӳ���ˮ�⣬��Һ��ʾ���ԣ���ϵ���غ��жϴ�������Һ�и�����Ũ�ȴ�С��
��2��NaOH��CH3COOH��Ũ�Ȱ�1��2����Ȼ�Ϻ�õ���Һ������Ϊ��Ũ�ȵ�CH3COOH��CH3COONa�Ļ����Һ��pH��7��˵���������ˮ�⣬�ݴ˱Ƚ�����Ũ�ȴ�С��
��3������Ϊ���ᣬpH=2�Ĵ�����Һ�д����Ũ�ȴ���0.01mol��L��1��pH=12������������Һ��Ũ��Ϊ0.01mol��L��1������Һ��Ϻ�����������Һ��ʾ���ԣ���c��H������c��OH������Ȼ����ݵ���غ��ж���Һ������Ũ�ȴ�С��
��4��n��CO2��=2.24L��22.4L��mol��1=0.1mol��n��NaOH��=1L��0.15mol��L��1=0.15mol��������2CO2+3OH��=CO32��+HCO3��+H2O�����CO32��+H2O![]() HCO3��+OH����HCO3��+H2O
HCO3��+OH����HCO3��+H2O![]() H2CO3+OH����
H2CO3+OH����
��5����Ҫ�Ƚ���Һ������Ũ�ȴ�С˳��Ӧ��ȷ����Һ�е����ʼ������ķ�Ӧ��
��1�����������Ũ�ȵ�CH3COOH��NaOH��Һ��ϣ���Ӧ������Ϊ�����ƣ���������Ӳ���ˮ�⣬��Һ��ʾ���ԣ���c��OH������c��H���������ݵ���غ�ɵã�c��Na������c��CH3COO��������Һ������Ũ�ȴ�СΪ��c��Na������c��CH3COO������c��OH������c��H������
��2��NaOH��CH3COOH��Ũ�Ȱ�1��2����Ȼ�Ϻ�õ���Һ������Ϊ��Ũ�ȵ�CH3COOH��CH3COONa�Ļ����Һ��pH��7��˵���������ˮ�⣬��Һ������Ũ�ȴ�СΪ��c��CH3COO������c��Na������c��H������c��OH������
��3������Ϊ������ʣ�pH=2�Ĵ�����Һ�д����Ũ�ȴ���0.01mol��L��1��pH=12������������Һ��Ũ��Ϊ0.01mol��L��1������Һ��Ϻ�����������Һ��ʾ���ԣ���c��H������c��OH���������ݵ���غ�c��CH3COO����+c��OH����=c��Na����+c��H�����ɵã�c��CH3COO������c��Na��������Һ������Ũ�ȴ�СΪ��c��CH3COO������c��Na������c��H������c��OH������
��4��n��CO2��=2.24L��22.4L��mol��1=0.1mol��n��NaOH��=1L��0.15mol��L��1=0.15mol��������2CO2+3OH��=CO32��+HCO3��+H2O�����CO32��+H2O![]() HCO3��+OH����HCO3��+H2
HCO3��+OH����HCO3��+H2![]() H2CO3+OH����
H2CO3+OH����
n��CO32����+n��HCO3����+n��H2CO3��=0.1mol��n��Na����=0.15mol���ִ��ڢ�CO32��+H2O![]() HCO3��+OH������HCO3��+H2O
HCO3��+OH������HCO3��+H2O![]() H2CO3+OH����ˮ��̶Ȣ٣�����ˮ��̶ȶ���С����c��HCO3������c��CO32������c��OH����������c��Na������c��HCO3������c��CO32������c��OH������c��H������
H2CO3+OH����ˮ��̶Ȣ٣�����ˮ��̶ȶ���С����c��HCO3������c��CO32������c��OH����������c��Na������c��HCO3������c��CO32������c��OH������c��H������
��5����Ҫ�Ƚ���Һ������Ũ�ȴ�С˳��Ӧ��ȷ����Һ�е����ʡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.2000mol/L��NaOH��Һ��μ��뵽20.00mL0.2000mol/LNH4Cl��Һ�У���Һ��pH������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ(�����ǻӷ�)������˵��������ǣ� ��

A.a����Һ�У�c(NH3H2O)+c(H+)=c(OH-)+c(NH4+)
B.��a�㵽d��ˮ�ĵ���̶Ȳ��ϼ���
C.b����Һ�У�c(Cl-)>c(Na+)>c(H+)=c(OH-)
D.c����Һ�У�c(NH3H2O)+c(NH4+)=2c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������������ˮ��pH��5.0~6.0֮�䣬ͨ���������Fe(OH)3���壬Fe(OH)3��������������ã�������ˮ�е������ʹ�������������ˮ�����ã���ԭ����ͼ��ʾ������˵����ȷ����

A. ʯī�缫�Ϸ���������Ӧ B. ͨ����ĵ缫��Ӧʽ��CH4+4CO32--8e-=5CO2+2H2O
C. ͨ�����ĵ缫��ӦʽΪO2+4e-=2O2- D. ����ȼ�ϵ����CO32-�����һ���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1200��ʱ����Ȼ���������лᷢ�����з�Ӧ
��H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ��H1
O2(g)=SO2(g)+H2O(g) ��H1
��2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ��H2
S2(g)+2H2O(g) ��H2
��H2S(g)+![]() O2(g)=S(g)+H2O(g) ��H3
O2(g)=S(g)+H2O(g) ��H3
��2S(g) =S2(g) ��H4
����H4����ȷ����ʽΪ�� ��
A. ��H4=2/3����H1+��H2-3��H3��
B. ��H4=2/3��3��H3-��H1-��H2��
C. ��H4=3/2����H1+��H2-3��H3��
D. ��H4=3/2����H1-��H2-3��H3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܹ��ɹ�����
A. �����������������Ƿ���ʣ�����![]() ��ɫ����
��ɫ����![]() �������ܽ���˵�������ѱ���
�������ܽ���˵�������ѱ���
B. ��ȥ�����к��е���������ʣ�����![]()
![]() ����
����
C. ����ij��Һ���Ƿ���Fe2+������![]() ��Һ��ɫ�ޱ仯��Һ
��Һ��ɫ�ޱ仯��Һ![]() ���ɫ����Һ�к���Fe2+
���ɫ����Һ�к���Fe2+
D. ֤����������H2O2�������Ա�I2ǿ��NaI��Һ![]() ��Һ����ɫ�������ԣ�H2O2��I2
��Һ����ɫ�������ԣ�H2O2��I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ�Ͽ�����CO��CO2������ȼ�ϼ״���ij�о�С��������йؼ״���ȡ��������ѧ��Ӧԭ������̽������֪�ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ��(K1��K2��K3)���±���ʾ��
��ѧ��Ӧ | �ʱ� | ƽ�ⳣ�� | �¶�/�� | ||
500 | 700 | 800 | |||
��2H2(g)��CO(g) | ��H1 | K1 | 2.5 | 0.34 | 0.15 |
��CO2(g)��H2(g) | ��H2 | K2 | 1.0 | 1.70 | 2.52 |
��CO2(g)��3H2(g) | ��H3 | K3 | |||
��ش��������⣺
(1)��Ӧ����________(��������������������)��Ӧ��
(2)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��________(��K1��K2��ʾ)�����ݷ�Ӧ���ж���S___0(����>��������������<��)����______(�����ϸ��������ϵ���)�¶��������ڸ÷�Ӧ�Է����С�
(3)500��ʱ����÷�Ӧ����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.1mol/L��0.8mol/L��0.3mo/L��0.15mol/L�����ʱv��________v��(����>��������������<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ����Ȼ�����Һ��ʪ����ֽ�ֱ����ס�������ʵ�飬�����жϴ������
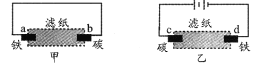
A. ����ԭ��أ����ǵ���
B. ����������������������ʴ
C. d�缫�ϵĵ缫��Ӧ�ǣ�Fe��2e �� Fe2��
D. b�缫�ϵĵ缫��Ӧ�ǣ�O2 + 2H2O + 4e �� 4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ��ij��Һ����ˮ���������c(H��)��c(OH��)�ij˻�Ϊ1��10��18��������˵����ȷ����(����)
A.����Һ��pHһ����9B.����Һ��pH����Ϊ5
C.����Һ��pH������7D.��������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽�����ʵĽṹ�����ڶ����ʵ����ʽ����о���
��1���� ���������к����Ȼ�����__________________(����ĸ)��
a��![]() b��
b��![]() c��
c��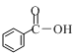
�� �������ʷ���������ԭ�Ӵ���ͬһƽ�����__________________(����ĸ)��
a���� b����ϩ c���״�
��2����ϩʹ��ˮ��������Ȼ�̼��Һ��ɫ�Ļ�ѧ����ʽ��_____________________
��3���Ҵ��Ĵ�������Ӧ�Ļ�ѧ����ʽ��___________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com