
ΓΨΧβΡΩΓΩ“Μ÷±Ζ¥”ΠΘΚ2NO2Θ®ΚλΉΊ…ΪΘ©![]() N2O4Θ®Έό…ΪΘ© ΓςHΘΦ0Θ§‘Ύ100Γφ ±Θ§ΫΪ0.40mol NO2ΤχΧε≥δ»κ2LΟή±’»ίΤς÷–Θ§ΟΩΗτ“ΜΕΈ ±ΦδΕ‘ΗΟ»ίΤςΒΡΈο÷ Ϋχ––≤βΝΩΘ§ΒΟΒΫΒΡ ΐΨί»γœ¬±μΘΚ
N2O4Θ®Έό…ΪΘ© ΓςHΘΦ0Θ§‘Ύ100Γφ ±Θ§ΫΪ0.40mol NO2ΤχΧε≥δ»κ2LΟή±’»ίΤς÷–Θ§ΟΩΗτ“ΜΕΈ ±ΦδΕ‘ΗΟ»ίΤςΒΡΈο÷ Ϋχ––≤βΝΩΘ§ΒΟΒΫΒΡ ΐΨί»γœ¬±μΘΚ
±Φδ/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
Θ®1Θ©aΓΔbΓΔcΓΔdΓΔe÷– τ”ΎΤΫΚβΉ¥Χ§ΒΡ «_____________Θ§100sΚσΫΒΒΆΖ¥”ΠΜλΚœΈοΒΡΈ¬Ε»Θ§ΜλΚœΤχΧεΒΡ―’…Ϊ_________Θ®ΧνΓΑ±δ«≥Γ±ΓΔΓΑ±δ…νΓ±ΜρΓΑ≤Μ±δΓ±Θ©ΓΘ
Θ®2Θ©20~40sΡΎΘ§v(NO2)=__________mol/(LΓΛs)Θ§100Γφ ±ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK =_____________ΓΘ
Θ®3Θ©ΫΪ“ΜΕ®ΝΩΒΡNO2≥δ»κΟή±’ΉΔ…δΤς÷–Θ§ΆΦ «‘Ύά≠…λΚΆ―ΙΥθΉΔ…δΤςΒΡΙΐ≥Χ÷–ΤχΧεΆΗΙβ¬ Υφ ±ΦδΒΡ±δΜ·Θ®ΤχΧε―’…Ϊ‘Ϋ…νΘ§ΆΗΙβ¬ ‘Ϋ–ΓΘ©ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «______________

A.bΒψΒΡ≤ΌΉς «―ΙΥθΉΔ…δΤς
B.cΒψ”κaΒψœύ±»Θ§c(NO2)‘ω¥σΘ§c(N2O4)Φθ–Γ
C.»τΟή±’ΉΔ…δΤςΈΣΨχ»»»ίΤςΘ§‘ρT(b)ΘΨT(c)
D.dΒψ ±vΘ®’ΐΘ©ΘΨvΘ®ΡφΘ©
Θ®4Θ©ΡήΥΒΟςΖ¥”Π2NO2Θ®ΚλΉΊ…ΪΘ©![]() N2O4Θ®Έό…ΪΘ©¥οΤΫΚβΒΡ «_________
N2O4Θ®Έό…ΪΘ©¥οΤΫΚβΒΡ «_________
A. ΧεœΒΒΡ―’…Ϊ≤Μ±δ
B. Κψ»ίΧθΦΰœ¬Θ§ΤχΧεΒΡΕνΟήΕ»≤Μ±δ
C. 2v’ΐΘ®NO2Θ©=vΡφΘ®N2O4Θ©/p>
D. ΜλΚœΤχΧεΒΡΤΫΨυΡΠΕϊ÷ ΝΩ≤Μ±δ
Θ®5Θ©100Γφ ±Θ§»ίΤς÷–Έο÷ ΒΡΝΩΒΡ±δΜ·«ζœΏ»γΆΦΘ§«κΜ≠≥ω80Γφ ±Έο÷ ΒΡΝΩΒΡ±δΜ·«ζœΏ≤ΔΫχ–– Β±±ξΉΔΓΘ______

ΓΨ¥πΑΗΓΩcde ±δ«≥ 0.001 2.78 A AD 
ΓΨΫβΈωΓΩ
Θ®1Θ©ΗυΨίΆΦ±μ÷–ΒΡ–≈œΔΩ…÷ΣΘ§60sΚσN2O4≈®Ε»≤Μ‘ΌΖΔ…ζ±δΜ·Θ§‘ρ NO2ΒΡ≈®Ε»“≤≤Μ‘ΌΖΔ…ζ±δΜ·Θ§Φ¥¥οΒΫΜ·―ßΤΫΚβΘ§100s÷°ΚσΘ§ΫΒΒΆΈ¬Ε»Θ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§¥”Εχ≈–Εœ≥ωΤχΧε―’…ΪΒΡ±δΜ·ΘΜ
Θ®2Θ©ΗυΨίΈο÷ ΒΡΝΩ±δΜ·÷°±»Β»”ΎΦΤΝΩ ΐ÷°±»Θ§Υψ≥ωbΒΡ÷ΒΘ§άϊ”ΟΥΌ¬ ΙΪ ΫΒΟΒΫv(NO2)Θ§60min¥οΒΫΤΫΚβΘ§άϊ”ΟΤΫΚβ≈®Ε»Υψ≥ωΤΫΚβ≥Θ ΐKΘΜ
Θ®3Θ©ΗΟΖ¥”Π «’ΐΖ¥”ΠΤχΧεΧεΜΐΦθ–ΓΒΡΖ≈»»Ζ¥”ΠΘ§―Ι«Ω‘ω¥σΤΫΚβΥδ’ΐœρ“ΤΕ·Θ§ΒΪΕΰ―θΜ·ΒΣ≈®Ε»‘ω¥σΘ§ΜλΚœΤχΧε―’…Ϊ±δ…νΘ§―Ι«ΩΦθ–ΓΤΫΚβΡφœρ“ΤΕ·Θ§ΒΪΕΰ―θΜ·ΒΣ≈®Ε»Φθ–ΓΘ§ΜλΚœΤχΧε―’…Ϊ±δ«≥Θ§ΨίΆΦΖ÷ΈωΘ§bΒψΩΣ Φ «―ΙΥθΉΔ…δΤςΒΡΙΐ≥ΧΘ§ΤχΧε―’…Ϊ±δ…νΘ§ΆΗΙβ¬ ±δ–ΓΘ§cΒψΚσΒΡΙ’Βψ «ά≠…λΉΔ…δΤςΒΡΙΐ≥ΧΘ§ΤχΧε―’…Ϊ±δ«≥Θ§ΆΗΙβ¬ ‘ω¥σΘ§Ψί¥ΥΖ÷ΈωΘΜ
Θ®4Θ©Ω…ΡφΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§ ±Θ§ΗςΈο÷ ΒΡΈο÷ ΒΡΝΩΓΔΈο÷ ΒΡΝΩ≈®Ε»ΓΔΑΌΖ÷Κ§ΝΩ“‘ΦΑ”…¥Υ“ΐΤπΒΡ“ΜœΒΝ–ΈοάμΝΩ≤Μ±δΘΜ
Θ®5Θ©ΫΒΒΆΈ¬Ε»Θ§Ζ¥”ΠΥΌ¬ Φθ¬ΐΘ§¥οΒΫΤΫΚβΒΡ ±Φδ±δ≥ΛΘΜΓςHΘΦ0Θ§ΫΒΒΆΈ¬Ε»Θ§Ζ¥”Π’ΐœρ“ΤΕ·Θ§NO2ΒΡΈο÷ ΒΡΝΩΦθ–ΓΘ§Ι ΆΦœώΈΣ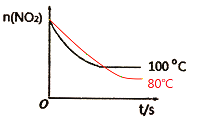 ΘΜ
ΘΜ
Θ®1Θ©n(NO2)= 0.40mol-0.26mol=0.14molΘ§‘ρn(N2O4)=![]() n(NO2)=0.07molΘ§‘ρΗυΨί±μΗώN2O4ΒΡΈο÷ ΒΡΝΩ±δΜ·Ω…÷ΣΘ§60s ±Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§‘ρaΓΔbΓΔcΓΔdΓΔe÷– τ”ΎΤΫΚβΉ¥Χ§ΒΡ «cdeΘΜ”…”ΎΓςHΘΦ0Θ§100sΚσΫΒΒΆΖ¥”ΠΜλΚœΈοΒΡΈ¬Ε»Θ§Ζ¥”Πœρ’ΐœρ“ΤΕ·Θ§»ίΤς÷–ΜλΚœΤχΧεΒΡ―’…Ϊ”…ΚλΉΊ…Ϊ÷πΫΞ±δ«≥Θ§
n(NO2)=0.07molΘ§‘ρΗυΨί±μΗώN2O4ΒΡΈο÷ ΒΡΝΩ±δΜ·Ω…÷ΣΘ§60s ±Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§‘ρaΓΔbΓΔcΓΔdΓΔe÷– τ”ΎΤΫΚβΉ¥Χ§ΒΡ «cdeΘΜ”…”ΎΓςHΘΦ0Θ§100sΚσΫΒΒΆΖ¥”ΠΜλΚœΈοΒΡΈ¬Ε»Θ§Ζ¥”Πœρ’ΐœρ“ΤΕ·Θ§»ίΤς÷–ΜλΚœΤχΧεΒΡ―’…Ϊ”…ΚλΉΊ…Ϊ÷πΫΞ±δ«≥Θ§
Ι ¥πΑΗΈΣΘΚcdeΘΜ±δ«≥ΘΜ
Θ®2Θ©Γςt=40s-20s=20sΘ§0~20sΡΎΘ§n(N2O4)=0.05molΘ§‘ρn(NO2)=2n(N2O4)=0.1molΘ§Ι 20s ±n(NO2)=a=0.4-0.1=0.3molΘ§20~40sΡΎn(NO2)=0.3-0.26=0.04molΘ§c(NO2)=![]() =
=![]() =0.02mol/Lȧv(NO2)=
=0.02mol/Lȧv(NO2)=![]() =
=![]() = 0.001mol/(LΓΛs)ΘΜ
= 0.001mol/(LΓΛs)ΘΜ
”…(1)Ω…ΒΟΘ§Ζ¥”Π60s¥οΒΫΤΫΚβΘ§0~60s ±Θ§n(N2O4)=0.08molΘ§‘ρn(NO2)=2n(N2O4)=0.16molΘ§Ι 60s ±n(NO2)=c=0.4-0.16=0.24molΘ§Ι 100Γφ ±ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK =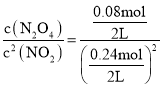 Θ§Γ÷2.78Θ§
Θ§Γ÷2.78Θ§
Ι ¥πΑΗΈΣΘΚ0.001ΘΜ2.78ΘΜ
Θ®3Θ©A. ¥”bΒψΒΫcΒΡΙΐ≥Χ÷–ΆΗΙβ¬ Φθ–ΓΘ§ΥΒΟςNO2ΒΡ≈®Ε»‘ωΦ”Θ§“ρ¥Υ «―ΙΥθΉΔ…δΤςΘ§―ΙΥθ Ι»ίΤς―Ι«Ω‘ω¥σΘ§“ρ¥ΥΤΫΚβ’ΐœρ“ΤΕ·Θ§Ι A’ΐ»ΖΘΜ
B. cΒψ «―ΙΥθΉΔ…δΤςΚσΒΡ«ιΩωΘ§Εΰ―θΜ·ΒΣΚΆΥΡ―θΜ·ΕΰΒΣΒΡ≈®Ε»ΕΦ‘ω¥σΘ§Ι B¥μΈσΘΜ
C. bΒψΩΣ Φ «―ΙΥθΉΔ…δΤςΒΡΙΐ≥ΧΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§Ζ¥”ΠΖ≈»»Θ§ΒΦ÷¬T(b)<T(c)Θ§Ι C¥μΈσΘΜ
D. cΒψΚσΒΡΙ’Βψ «ά≠…λΉΔ…δΤςΒΡΙΐ≥ΧΘ§dΒψ «ΤΫΚβœρΤχΧεΧεΜΐ‘ω¥σΒΡΡφœρ“ΤΕ·Ιΐ≥ΧΘ§Υυ“‘v(Ρφ)>v(’ΐ)Θ§Ι D¥μΈσΘΜ
Ι ¥πΑΗ―ΓAΘΜ
Θ®4Θ©A.»ίΤςΡΎΤχΧε―’…Ϊ≤Μ‘ΌΖΔ…ζ±δΜ· ±Θ§Εΰ―θΜ·ΒΣ≈®Ε»≤Μ±δΘ§Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§Ι A’ΐ»ΖΘΜ
B.Ζ¥”Π«ΑΚσΤχΧεΉή÷ ΝΩ≤Μ±δΘ§»ίΤςΧεΜΐ≤Μ±δΘ§‘ρ»ίΤςΡΎΤχΧεΟήΕ» Φ÷’≤Μ±δΘ§≤ΜΡήΨί¥Υ≈–ΕœΤΫΚβΉ¥Χ§Θ§Ι B¥μΈσΘΜ
C.v(NO2)’ΐ=2v(N2O4)Ρφ ±Ζ¥”Π¥οΒΫΤΫΚβΉ¥Χ§Θ§‘ρ2v(NO2)’ΐ=v(N2O4)Ρφ ±ΗΟΖ¥”ΠΟΜ”–¥οΒΫΤΫΚβΉ¥Χ§CΘ§Ι C¥μΈσΘΜ
D. ΜλΚœΤχΧεΒΡΤΫΨυΡΠΕϊ÷ ΝΩ=ΤχΧεΈο÷ ΒΡΉή÷ ΝΩ/ΤχΧεΒΡΉήΈο÷ ΒΡΝΩΘΜΤχΧεΈο÷ ΒΡΉή÷ ΝΩ «“ΜΗωΕ®÷ΒΘ§ΤχΧεΒΡΉήΈο÷ ΒΡΝΩ «“ΜΗω±δ÷ΒΘ§Ι ΜλΚœΤχΧεΒΡΤΫΨυΡΠΕϊ÷ ΝΩ≤Μ±δΘ§Μ·―ßΖ¥”Π¥οΒΫΤΫΚβΘ§Ι D’ΐ»ΖΘΜ
Ι ¥πΑΗ―ΓADΘΜ
Θ®5Θ©ΫΒΒΆΈ¬Ε»Θ§Ζ¥”ΠΥΌ¬ Φθ¬ΐΘ§¥οΒΫΤΫΚβΒΡ ±Φδ±δ≥ΛΘΜΓςHΘΦ0Θ§ΫΒΒΆΈ¬Ε»Θ§Ζ¥”Π’ΐœρ“ΤΕ·Θ§NO2ΒΡΈο÷ ΒΡΝΩΦθ–ΓΘ§Ι ΆΦœώΈΣ Θ§
Θ§
Ι ¥πΑΗΈΣΘΚ ΓΘ
ΓΘ


 Ή¥‘ΣΖΜ»Ϊ≥ΧΆΜΤΤΒΦΝΖ≤βœΒΝ–¥πΑΗ
Ή¥‘ΣΖΜ»Ϊ≥ΧΆΜΤΤΒΦΝΖ≤βœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ1200Γφ ±Θ§Χλ»ΜΤχΆ―ΝρΙΛ“’÷–ΜαΖΔ…ζœ¬Ν–Ζ¥”Π
ΔΌH2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΓςH1
O2(g)=SO2(g)+H2O(g) ΓςH1
ΔΎ2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΓςH2
S2(g)+2H2O(g) ΓςH2
ΔέH2S(g)+![]() O2(g)=S(g)+H2O(g) ΓςH3
O2(g)=S(g)+H2O(g) ΓςH3
Δή2S(g) =S2(g) ΓςH4
‘ρΓςH4ΒΡ’ΐ»Ζ±μ¥ο ΫΈΣΘ® Θ©
A. ΓςH4=2/3Θ®ΓςH1+ΓςH2-3ΓςH3Θ©
B. ΓςH4=2/3Θ®3ΓςH3-ΓςH1-ΓςH2Θ©
C. ΓςH4=3/2Θ®ΓςH1+ΓςH2-3ΓςH3Θ©
D. ΓςH4=3/2Θ®ΓςH1-ΓςH2-3ΓςH3Θ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ25 Γφ ±Θ§Ρ≥»ή“Κ÷–”…Υ°Βγάκ≤ζ…ζΒΡc(HΘΪ)ΚΆc(OHΘ≠)ΒΡ≥ΥΜΐΈΣ1ΓΝ10Θ≠18Θ§‘ρœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «(ΓΓΓΓ)
A.ΗΟ»ή“ΚΒΡpH“ΜΕ® «9B.ΗΟ»ή“ΚΒΡpHΩ…ΡήΈΣ5
C.ΗΟ»ή“ΚΒΡpHΩ…Ρή «7D.≤ΜΜα”–’β―υΒΡ»ή“Κ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬Θ§”Ο0.100molΓΛL-1ΒΡNaOH»ή“ΚΖ÷±πΒΈΕ®ΨυΈΣ20.00mL0.100molΓΛL-1ΒΡHCl»ή“ΚΚΆ¥ΉΥα»ή“ΚΘ§ΒΈΕ®«ζœΏ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «

A. I±μ ΨΒΡ «ΒΈΕ®¥ΉΥαΒΡ«ζœΏ
B. pH =7 ±Θ§ΒΈΕ®¥ΉΥαœϊΚΡΒΡV(NaOH)ΘΨ20.00mL
C. V(NaOH)= 20.00mL ±Θ§ΝΫΖί»ή“Κ÷–c(Cl-)ΘΨc(CH3COO-)
D. V(NaOH)=10.00mL ±Θ§¥ΉΥα÷–c(Na+)ΘΨc(CH3COO-)ΘΨc(H+)ΘΨc(OH-)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“Μ÷÷…ζ≤ζΨέ±Ϋ““œ©ΒΡΝς≥Χ»γœ¬Θ§œ¬Ν––π ω≤Μ’ΐ»ΖΒΡ «

A.ΔΌ «Φ”≥…Ζ¥”Π
B.““±ΫΚΆ«βΤχΦ”≥…ΚσΒΡ≤ζΈοΒΡ“Μ¬»¥ζΈο”–5÷÷
C.Φχ±π““±Ϋ”κΨέ±Ϋ““œ©≤ΜΩ…”ΟBr2ΒΡΥΡ¬»Μ·ΧΦ»ή“Κ
D.““œ©ΚΆΨέ±Ϋ““œ©ΨυΩ…“‘ΚΆH2 ΖΔ…ζΦ”≥…Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥–Θ―ß…ζ”Οœ¬ΆΦΥυ ΨΉΑ÷ΟΫχ–– Β―ιΓΘ“‘ΧΫΨΩ±Ϋ”κδεΖΔ…ζΖ¥”ΠΒΡ‘≠άμ≤ΔΖ÷άκΧα¥ΩΖ¥”ΠΒΡ≤ζΈοΓΘ

«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)–¥≥ωΉΑ÷ΟΔρ÷–ΖΔ…ζΒΡ÷ς“ΣΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ____________________________Θ§Τδ÷–άδΡΐΙήΥυΤπΒΡΉς”ΟΈΣΒΦΤχΚΆ________Θ§Δτ÷–«ρ–ΈΗ…‘οΙήΒΡΉς”Ο «__________ΓΘ
(2) Β―ιΩΣ Φ ±Θ§ΙΊ±’K2ΓΔΩΣΤτK1ΚΆΖ÷“Κ¬©ΕΖΜν»ϊΘ§ΒΈΦ”±ΫΚΆ“ΚδεΒΡΜλΚœ“ΚΘ§Ζ¥”ΠΩΣ ΦΓΘΔσ÷––Γ ‘ΙήΡΎ±ΫΒΡΉς”Ο «_________________________ΓΘ
(3)ΡήΥΒΟς±Ϋ”κ“ΚδεΖΔ…ζΝΥ»Γ¥ζΖ¥”ΠΒΡœ÷œσ «______________________ΓΘ
(4)Ζ¥”ΠΫα χΚσΘ§“Σ»ΟΉΑ÷ΟΔώ÷–ΒΡΥ°ΒΙΈϋ»κΉΑ÷ΟΔρ÷–“‘≥ΐ»ΞΉΑ÷ΟΔρ÷–≤–”ύΒΡHBrΤχΧεΓΘΦρ ω»γΚΈ Βœ÷’β“Μ≤ΌΉςΘΚ______________________________________ΓΘ
(5)¥ΩΨΜΒΡδε±Ϋ «Έό…Ϊ”ΆΉ¥ΒΡ“ΚΧεΘ§’βΗωΉΑ÷Ο÷ΤΒΟΒΡδε±Ϋ≥ ΚλΉΊ…ΪΘ§‘≠“ρ «άοΟφΜλ”–______________Θ§ΫΪ»ΐΨ±…’ΤΩΡΎΖ¥”ΠΚσΒΡ“ΚΧε“ά¥ΈΫχ––œ¬Ν– Β―ι≤ΌΉςΨΆΩ…ΒΟΒΫΫœ¥ΩΨΜΒΡδε±ΫΓΘΔΌ”Ο’τΝσΥ°œ¥Β”Θ§’ώΒ¥Θ§Ζ÷“ΚΘΜΔΎ”Ο__________œ¥Β”Θ§’ώΒ¥Θ§Ζ÷“ΚΘΜΔέ’τΝσΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧΫΨΩΈο÷ ΒΡΫαΙΙ”–÷ζ”ΎΕ‘Έο÷ ΒΡ–‘÷ Ϋχ––―–ΨΩΓΘ
Θ®1Θ©ΔΌ œ¬Ν–Έο÷ ÷–Κ§”–τ»ΜυΒΡ «__________________(ΧνΉ÷ΡΗ)ΓΘ
aΘ°![]() bΘ°
bΘ°![]() cΘ°
cΘ°
ΔΎ œ¬Ν–Έο÷ Ζ÷Ή”÷–Υυ”–‘≠Ή”¥Π”ΎΆ§“ΜΤΫΟφΒΡ «__________________(ΧνΉ÷ΡΗ)ΓΘ
aΘ°±Ϋ bΘ°±ϊœ© cΘ°ΦΉ¥Φ
Θ®2Θ©““œ© ΙδεΥ°ΜρδεΒΡΥΡ¬»Μ·ΧΦ»ή“ΚΆ …ΪΒΡΜ·―ßΖΫ≥Χ ΫΘΚ_____________________
Θ®3Θ©““¥ΦΒΡ¥ΏΜ·―θΜ·Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ___________________________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬Θ§”Ο0.1000 molΓΛLΘ≠1NaOH»ή“ΚΒΈΕ®20.00 mLΈ¥÷Σ≈®Ε»ΒΡ―ΈΥα(Ζ”ΧΣΉς÷Η ΨΦΝ)ΒΡΒΈΕ®«ζœΏ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©

A.»ή“Κ÷–ΒΡ«βάκΉ”≈®Ε»ΘΚa<b
B.―ΈΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ0.0100molΓΛLΘ≠1
C.÷Η ΨΦΝ±δ…Ϊ ±Θ§ΥΒΟς―ΈΥα”κNaOH«ΓΚΟΆξ»ΪΖ¥”Π
D.Β±ΒΈΦ”NaOH»ή“Κ10.00mL ±(Κω¬‘Ζ¥”Π«ΑΚσΧεΜΐ±δΜ·)Θ§ΗΟΜλΚœ“ΚΒΡpHΘΫ1ΘΪlg3
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“ΜΕ®ΧθΦΰœ¬¥φ‘ΎΖ¥”ΠΘΚ2SO2(g) + O2(g) ![]() 2SO3(g)Θ§ΠΛ HΘΦ0ΓΘœ÷”–»ΐΗωΧεΜΐœύΆ§ΒΡΟή±’»ίΤςΔώΓΔΔρΓΔΔσΘ§Α¥»γ»γΆΦΥυ ΨΆΕΝœΘ§≤Δ‘Ύ400ΓφΧθΦΰœ¬ΩΣ ΦΖ¥”ΠΓΘ¥οΒΫΤΫΚβ ±Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
2SO3(g)Θ§ΠΛ HΘΦ0ΓΘœ÷”–»ΐΗωΧεΜΐœύΆ§ΒΡΟή±’»ίΤςΔώΓΔΔρΓΔΔσΘ§Α¥»γ»γΆΦΥυ ΨΆΕΝœΘ§≤Δ‘Ύ400ΓφΧθΦΰœ¬ΩΣ ΦΖ¥”ΠΓΘ¥οΒΫΤΫΚβ ±Θ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «

A. »ίΤςIΓΔIII÷–ΤΫΚβ≥Θ ΐœύΆ§
B. »ίΤςIIΓΔIII÷–’ΐΖ¥”ΠΥΌ¬ œύΆ§
C. »ίΤςIIΓΔIII÷–ΒΡΖ¥”Π¥οΤΫΚβ ±Θ§SO3ΒΡΧεΜΐΖ÷ ΐΘΚII>III
D. »ίΤςI÷–SO2ΒΡΉΣΜ·¬ ”κ»ίΤςII÷–SO3ΒΡΉΣΜ·¬ ÷°ΚΆ–Γ”Ύ1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com