
ЁОЬтФПЁПКьШШЕФЬПгыХЈСђЫсПЩЗЂЩњЗДгІЁЃ
ЃЈ1ЃЉаДГіИУЛЏбЇЗДгІЗНГЬЪНЃЛВЂгУЁАЫЋЯпЧХЁББъГіИУЗДгІжаЕчзгЕФзЊвЦЕФЗНЯђКЭЪ§ФП___ЁЃ
ЃЈ2ЃЉЯжгћЩшМЦвЛИіЪЕбщвдбщжЄДЫЗДгІЫљЩњГЩЕФИїжжВњЮяЁЃЪЕбщжаПЩЙЉЪЙгУЕФЪдМСгаЃКХЈСђЫсЁЂЯЁСђЫсЁЂГЮЧхЪЏЛвЫЎЁЂNaOHШмвКЁЂЦЗКьШмвКЁЂЫсадИпУЬЫсМиШмвКЁЂЮоЫЎСђЫсЭЙЬЬхКЭМюЪЏЛвЁЃгавЛИіЭЌбЇАДЦјЬхЕФСїЖЏЗНЯђЩшМЦСЫвЛИіЪЕбщЙ§ГЬЃЌЦфЫљЪЙгУЕФЪдМСДЮађПЩБэЪОЮЊЃКЦјЬхВњЮяЁњЪдМСЂёЁњЪдМСЂђЁњЪдМСЂѓЁњЪдМСЂђЁњЪдМСЂє
ЂйЪдМСЂёЁЂЂђЁЂЂѓЁЂЂєЗжБ№ЮЊ___ЃЌ___ЃЌ___ЃЌ___ЃЛ
ЂкЫЕГіЪдМСЂђЪЙгУСНДЮЕФзїгУЗжБ№ЪЧ___ЃЌ___ЃЛ
ЂлаДГіЦјЬхВњЮяЭЈЙ§ЪдМСЂєЪБЕФРызгЗНГЬЪН___ЁЃ
ЁОД№АИЁП ЮоЫЎСђЫсЭЙЬЬх ЦЗКьШмвК ЫсадKMnO4ШмвК ГЮЧхЪЏЛвЫЎ МьбщЦјЬхВњЮяжаЪЧЗёгаSO2 ШЗШЯSO2ЦјЬхвбБЛГ§Эъ Ca2ЃЋЃЋCO2ЃЋ2OHЃЃНCaCO3Ё§ЃЋH2O
ЮоЫЎСђЫсЭЙЬЬх ЦЗКьШмвК ЫсадKMnO4ШмвК ГЮЧхЪЏЛвЫЎ МьбщЦјЬхВњЮяжаЪЧЗёгаSO2 ШЗШЯSO2ЦјЬхвбБЛГ§Эъ Ca2ЃЋЃЋCO2ЃЋ2OHЃЃНCaCO3Ё§ЃЋH2O
ЁОНтЮіЁП
(1)ФОЬПКЭХЈСђЫсМгШШЗДгІЩњГЩЖўбѕЛЏСђЁЂЖўбѕЛЏЬМКЭЫЎЃЛ
(2)бщжЄЬМКЭХЈСђЫсЗДгІЕФВњЮяашвЊЯШбщжЄЩњГЩЕФЫЎЃЌвРОнЮоЫЎСђЫсЭБфРЖЩЋЫЕУїЩњГЩЫЎЃЌдйбщжЄЖўбѕЛЏСђЃЌФмЪЙЦЗКьЪдвКЭЪЩЋЃЌГ§ШЅЖўбѕЛЏСђКѓдйгУЦЗКьЪдвКМьбщЪЧЗёГ§ОЁЃЌзюКѓгУГЮЧхЪЏЛвбщжЄЖўбѕЛЏЬМЁЃ
ЃЈ1ЃЉКьШШЕФЬПгыХЈСђЫсЗЂЩњЗДгІCЃЋ2H2SO4ЃЈХЈЃЉ![]() CO2ЁќЃЋ2SO2ЁќЃЋ2H2OЃЌЗДгІжаCдЊЫиЛЏКЯМлгЩ0МлЩ§ИпЕН+4МлЃЌЪЇЕчзгБЛбѕЛЏЃЌSдЊЫиЛЏКЯМлгЩ+6МлНЕЕЭЕН+4МлЃЌЕУЕчзгБЛЛЙдЃЌЛЏКЯМлБфЛЏЕФзюаЁЙЋБЖЪ§ЮЊ4ЃЌдђЕчзгЕФзЊвЦЗНЯђКЭЪ§ФППЩБэЪОЮЊ
CO2ЁќЃЋ2SO2ЁќЃЋ2H2OЃЌЗДгІжаCдЊЫиЛЏКЯМлгЩ0МлЩ§ИпЕН+4МлЃЌЪЇЕчзгБЛбѕЛЏЃЌSдЊЫиЛЏКЯМлгЩ+6МлНЕЕЭЕН+4МлЃЌЕУЕчзгБЛЛЙдЃЌЛЏКЯМлБфЛЏЕФзюаЁЙЋБЖЪ§ЮЊ4ЃЌдђЕчзгЕФзЊвЦЗНЯђКЭЪ§ФППЩБэЪОЮЊ ЃЛ
ЃЛ
(2)бщжЄЬМКЭХЈСђЫсЗДгІЕФВњЮяашвЊЯШбщжЄЩњГЩЕФЫЎЃЌвРОнЮоЫЎСђЫсЭБфРЖЩЋЫЕУїЩњГЩЫЎЃЌдйбщжЄЖўбѕЛЏСђЃЌФмЪЙЦЗКьЪдвКЭЪЩЋЃЌГ§ШЅЖўбѕЛЏСђКѓдйгУЦЗКьЪдвКМьбщЪЧЗёГ§ОЁЃЌзюКѓгУГЮЧхЪЏЛвбщжЄЖўбѕЛЏЬМ;ЫљвдЕквЛДЮЪЙгУЖўбѕЛЏСђЪБЕФзїгУЪЧМьбщЪЧЗёгаSO2ЩњГЩЃЌЕкЖўДЮЪЙгУЖўбѕЛЏСђЕФзїгУЪЧМьбщSO2ЪЧЗёГ§ОЛЃЌЪдМСIVЮЊЖўбѕЛЏЬМКЭГЮЧхЪЏЛвЫЎЗЂЩњЗДгІЩњГЩЬМЫсИЦГСЕэКЭЫЎЃЌ
ЂйЪдМСIЁЂЂђЁЂ ЂѓЁЂIVЗжБ№ЮЊЃКЮоЫЎСђЫсЭЁЂЦЗКьШмвКЁЂЫсадИпУЬЫсМиЁЂГЮЧхЪЏЛвЫЎЃЛ
ЂкЫЕГіЪдМСIЮЊЦЗКьШмвКЃЌЪЙгУСНДЮЕФзїгУЗжБ№ЪЧЕквЛДЮЪЙгУЪБЕФзїгУЪЧМьбщЪЧЗёгаSO2ЩњГЩЃЌЕкЖўДЮЪЙгУЕФзїгУЪЧМьбщSO2ЪЧЗёГ§ОЛЃЛ
ЂлЦјЬхВњЮяЭЈЙ§зуСПЕФЪдМСIVЪБЗЂЩњЗДгІЩњГЩЬМЫсИЦКЭЫЎЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃКCO2+Ca2+ +2OH-=CaCO3Ё§+H2OЁЃ


 ЭЌВНСЗЯАЧПЛЏЭиеЙЯЕСаД№АИ
ЭЌВНСЗЯАЧПЛЏЭиеЙЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЦЭПѓЃЈжївЊГЩЗжЮЊЖўСђЛЏбЧЬњЭЃКCuFeS2ЃЉЪЧжЦШЁЭМАЦфЛЏКЯЮяЕФжївЊдСЯжЎвЛЃЌЛЙПЩжЦБИСђМАЬњЕФЛЏКЯЮяЁЃвБСЖЭЕФЗДгІЮЊ8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2 ЁЃ
8Cu+4FeO+2Fe2O3+16SO2 ЁЃ
ЃЈ1ЃЉШєCuFeS2жаFeЕФЛЏКЯМлЮЊ+2ЃЌЗДгІжаБЛЛЙдЕФдЊЫиЪЧ__________ЃЈЬюдЊЫиЗћКХЃЉЁЃ
ЃЈ2ЃЉгУЯЁH2SO4НўХнЩЯЪіЗДгІжЦШЁЭКѓЪЃгрЕФЙЬЬхВадќЃЌШЁЩйСПЫљЕУШмвКЃЌМьбщШмвКжаДцдкFe3ЃЋЕФЗНЗЈЪЧ_________ЃЈзЂУїЪдМСЁЂЯжЯѓЁЂНсТлЃЉЁЃ
ЃЈ3ЃЉЩЯЪівБСЖЙ§ГЬВњЩњДѓСПSO2ЁЃЯТСаДІРэЗНАИжаКЯРэЕФЪЧ_____________ЃЈЬюДњКХЃЉ
a ИпПеХХЗХ b гУгкжЦБИСђЫс c гУДПМюШмвКЮќЪежЦNa2SO3 d гУХЈСђЫсЮќЪе
ЃЈ4ЃЉбщжЄЛЦЭПѓвБСЖЭЕФЗДгІКѓЦјЬхжаКЌгаSO2ЕФЗНЗЈЪЧ________________ЁЃ
ЃЈ5ЃЉЪЕбщЪвжЦБИЃЌЪеМЏИЩдяЕФSO2ЃЌЫљашвЧЦїШчЯТЁЃ
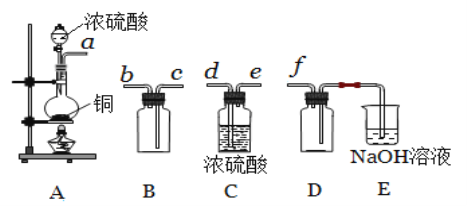
ЂйЦфжазАжУAВњЩњSO2 ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______________ЁЃ
ЂкЧыАДЦјСїЗНЯђСЌНгИївЧЦїНгПкЃЌЫГађЮЊa Ёњ_____Ёњ_______Ёњ________Ёњ _______Ёњ f ЃЌзАжУEжаNaOHШмвКЕФзїгУЪЧ____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊВтЖЈCuSO4ШмвКЕФХЈЖШЃЌМзЁЂввСНЭЌбЇЩшМЦСЫСНИіЗНАИЁЃЛиД№ЯТСаЮЪЬтЃК
Ђё.МзЗНАИ
ЪЕбщдРэЃК![]()
ЪЕбщВНжшЃК

(1)ХаЖЯ![]() ГСЕэЭъШЋЕФВйзїЮЊ____________ЁЃ
ГСЕэЭъШЋЕФВйзїЮЊ____________ЁЃ
(2)ВНжшЂкХаЖЯГСЕэЪЧЗёЯДОЛЫљбЁгУЕФЪдМСЮЊ_____________ЁЃ
(3)ВНжшЂлзЦЩеЪБЪЂзАбљЦЗЕФвЧЦїУћГЦЮЊ__________ЁЃ
(4)ЙЬЬхжЪСПЮЊwgЃЌдђc(CuSO4)=________molL-1ЁЃ
(5)ШєВНжшЂйДгЩеБжазЊвЦГСЕэЪБЮДЯДЕгЩеБЃЌдђВтЕУc(CuSO4)_________(ЬюЁАЦЋИпЁБЁЂЁАЦЋЕЭЁБЛђЁАЮогАЯьЁБ)ЁЃ
Ђђ.ввЗНАИ
ЪЕбщдРэЃК![]() ЃЌ
ЃЌ![]()

ЪЕбщВНжш:
ЂйАДгвЭМАВзАзАжУ(МаГжвЧЦїТдШЅ)
ЂкЁЁ
ЂлдквЧЦїAЁЂBЁЂCЁЂDЁЂEЁжаМгШыЭМЪОЕФЪдМС
ЂмЕїећDЁЂEжаСНвКУцЯрЦНЃЌЪЙDжавКУцБЃГждк0ЛђТдЕЭгк0ПЬЖШЮЛжУЃЌЖСЪ§ВЂМЧТМЁЃ
ЂнНЋCuSO4ШмвКЕЮШыAжаНСАшЃЌЗДгІЭъГЩКѓЃЌдйЕЮМгЯЁСђЫсжСЬхЯЕВЛдйгаЦјЬхВњЩњ
ЂоД§ЬхЯЕЛжИДЕНЪвЮТЃЌвЦЖЏEЙмЃЌБЃГжDЁЂEжаСНвКУцЯрЦНЃЌЖСЪ§ВЂМЧТМ
ЂпДІРэЪ§Он
(6)ВНжшЂкЮЊ___________ЁЃ
(7)ВНжшЂоашБЃжЄЬхЯЕЛжИДЕНЪвЮТЕФдвђЪЧ________(ЬюађКХ)ЁЃ
a.ЗДгІШШЪмЮТЖШгАЯь b.ЦјЬхУмЖШЪмЮТЖШгАЯь c.ЗДгІЫйТЪЪмЮТЖШгАЯь
(8)ZnЗлжЪСПЮЊagЃЌШєВтЕУH2ЬхЛ§ЮЊbmLЃЌвбжЊЪЕбщЬѕМўЯТ![]() ЃЌдђc(CuSO4)______molL-1(СаГіМЦЫуБэДяЪН)ЁЃ
ЃЌдђc(CuSO4)______molL-1(СаГіМЦЫуБэДяЪН)ЁЃ
(9)ШєВНжшЂоEЙмвКУцИпгкDЙмЃЌЮДЕївКУцМДЖСЪ§ЃЌдђВтЕУc(CuSO4)________(ЬюЁАЦЋИпЁБЁЂЁАЦЋЕЭЁБЛђЁАЮогАЯьЁБ)ЁЃ
(10)ЪЧЗёФмгУЭЌбљЕФзАжУКЭЗНЗЈВтЖЈMgSO4ШмвКЕФХЈЖШЃК_________(ЬюЁАЪЧЁБЛђЁАЗёЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАОЦЪЧГТЕФЯуЁБЃЌОЭЪЧвђЮЊОЦдкДЂДцЙ§ГЬжаЩњГЩСЫгаЯуЮЖЕФввЫсввѕЅЃЌдкЪЕбщЪвЮвУЧвВПЩвдгУШчЭМЫљЪОЕФзАжУжЦШЁввЫсввѕЅЁЃЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉаДГіжЦШЁввЫсввѕЅЕФЛЏбЇЗДгІЗНГЬЪН ЃЛ
ЃЈ2ЃЉХЈСђЫсЕФзїгУЪЧЃК ЃЛ
ЃЈ3ЃЉБЅКЭЬМЫсФЦШмвКЕФжївЊзїгУЪЧ___ ЁЃ
ЃЈ4ЃЉзАжУжаЭЈеєЦјЕФЕМЙмвЊВхдкБЅКЭЬМЫсФЦШмвКЕФвКУцЩЯЃЌВЛФмВхШыШмвКжаЃЌФПЕФЪЧ________________ЁЃ
ЃЈ5ЃЉШєвЊАбжЦЕУЕФввЫсввѕЅЗжРыГіРДЃЌгІВЩгУЕФЪЕбщВйзїЪЧ__________ЁЃ
ЃЈ6ЃЉЩњГЩввЫсввѕЅЕФЗДгІЪЧПЩФцЗДгІЃЌЗДгІЮяВЛФмЭъШЋБфГЩЩњГЩЮяЃЌЗДгІвЛЖЮЪБМфКѓЃЌОЭДяЕНСЫИУЗДгІЕФЯоЖШЃЌвВМДДяЕНЛЏбЇЦНКтзДЬЌЁЃЯТСаУшЪіФмЫЕУїввДМгыввЫсЕФѕЅЛЏЗДгІвбДяЕНЛЏбЇЦНКтзДЬЌЕФга(ЬюађКХ) ЁЃ
ЂйЕЅЮЛЪБМфРяЃЌЩњГЩ1molввЫсввѕЅЃЌЭЌЪБЩњГЩ1molЫЎ
ЂкЕЅЮЛЪБМфРяЃЌЩњГЩ1molввЫсввѕЅЃЌЭЌЪБЩњГЩ1molввЫс
ЂлЕЅЮЛЪБМфРяЃЌЯћКФ1molввДМЃЌЭЌЪБЯћКФ1molввЫс
Ђме§ЗДгІЕФЫйТЪгыФцЗДгІЕФЫйТЪЯрЕШ
ЂнЛьКЯЮяжаИїЮяжЪЕФХЈЖШВЛдйБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊввЯЉФмЗЂЩњвдЯТзЊЛЏЃК
(1)ввЯЉЕФНсЙЙМђЪНЮЊЃК______________
(2)аДГіЛЏКЯЮяЙйФмЭХЕФЛЏбЇЪНМАУћГЦЃК
ЂйBжаКЌЙйФмЭХ_________УћГЦ________ЃЛ
ЂкDжаКЌЙйФмЭХ__________УћГЦ_________ЃЛ
(3)аДГіЗДгІЕФЛЏбЇЗНГЬЪН
Ђй__________ЗДгІРраЭЃК___________
Ђк__________ЗДгІРраЭЃК___________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЯТСаЮяжЪжаЃКЂйHClЁЂЂкN2ЁЂЂлNH3ЁЂЂмNa2O2ЁЂЂнC2H4ЁЂЂоNaOHЁЂЂпAr
ЃЈ1ЃЉжЛДцдкМЋадМќЕФЗжзгЪЧ___ЃЛжЛгЩЗЧМЋадМќЙЙГЩЕФЗЧМЋадЗжзгЪЧ__ЃЛ(ЬюађКХЃЌЯТЭЌ)ЁЃ
ЃЈ2ЃЉCO32ЉЕФжааФдзгЕФдгЛЏЙьЕРРраЭЪЧ__ЃЌЮЂСЃЕФПеМфЙЙаЭЪЧ__ЁЃ
ЃЈ3ЃЉдкK3[FeЃЈCNЃЉ6]жажааФРызгЪЧ__ЃЌХфЬхЪЧ__ЃЌХфЮЛЪ§ЪЧ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШЦј(Cl2)ЪЧИпжаЛЏбЇвЛжжЗЧГЃживЊЕФЦјЬхЕЅжЪЃЌЫќЪЧжЦБИаэЖрЛЏЙЄВњЦЗЕФдСЯЁЃ
Ђё.МзЭЌбЇдкЪЕбщЪвгУЬхЛ§БШЮЊ1:3ЕФТШЦјКЭПеЦј(ВЛВЮгыЗДгІ)ЕФЛьКЯЦјЬхгыГБЪЊЕФЬМЫсФЦЗДгІРДжЦБИCl2OЃЌЦфЪЕбщзАжУШчЭМЫљЪОЁЃ

вбжЊЃКCl2OШлЕуЮЊ-120.6ЁцЃЌЗаЕуЮЊ2.0ЁцЃЌГЃЮТГЃбЙЯТЮЊвЛжжзиЛЦЩЋЦјЬхЁЃ
(1)вЧЦїBЕФУћГЦЮЊ________ЃЌKMnO4гыХЈбЮЫсЗДгІЩњГЩCl2ЕФРызгЗНГЬЪНЮЊ________ЁЃ
(2)зАжУCЕФзїгУЮЊ________ЃЌзАжУEжаЕФЯжЯѓЪЧ________ЁЃ
(3)ТШЦјгыГБЪЊЕФЬМЫсФЦжЦCl2OЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
Ђђ.ввЭЌбЇдкЪЕбщЪвгУCl2КЭШлШкЕФSЗДгІжЦБИS2Cl2ЃЌЦфЪЕбщзАжУШчЭМЫљЪОЁЃ

вбжЊЃКS2Cl2ШлЕуЮЊ-76ЁцЃЌЗаЕуЮЊ138ЁцЃЌГЃЮТЯТЮЊГШЛЦЩЋЕФвКЬхЃЌгіЫЎвзЫЎНтЁЃ
(4)WжаЪЂЗХЕФЪдМСЮЊ________ЁЃ
(5)ввЭЌбЇгІНјааКЯРэЕФВйзїЫГађЮЊ________(ЬюађКХ)ЁЃ
a.ЕуШМОЦОЋЕЦ b.ЭЃжЙЭЈТШЦј c.ПЊЪМЭЈТШЦј d.ЯЈУ№ОЦОЋЕЦ
(6)МьбщS2Cl2КЭЫЎЗДгІЕФВњЩњЕФЦјЬхЮЊSO2ЕФЪЕбщВйзїЮЊ________ЁЃ
(7)БОЪЕбщашИФНјЕФЕиЗНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЕФШнЛ§ВЛБфЕФУмБеШнЦїжаЃЌЯТСаа№ЪіВЛЪЧПЩФцЗДгІA(g)+3B(g)![]() 2C(g)+2D(s)ДяЕНЦНКтЕФБъжОЕФЪЧ
2C(g)+2D(s)ДяЕНЦНКтЕФБъжОЕФЪЧ
Ђй CЕФЩњГЩЫйТЪгыCЕФЯћКФЫйТЪЯрЕШ ЂкЕЅЮЛЪБМфФкЩњГЩamolA,ЭЌЪБЩњГЩ3amolB
Ђл AЁЂBЁЂCЕФХЈЖШВЛдйИФБф ЂмЛьКЯЦјЬхЕФУмЖШВЛдйИФБф
Ђн ЛьКЯЦјЬхЕФзмбЙЧПВЛдйИФБф ЂоЛьКЯЦјЬхЕФзмЮяжЪЕФСПВЛдйИФБф
Ђп AЁЂBЁЂCЁЂDХЈЖШжЎБШЮЊ1ЃК3ЃК2ЃК2
A. ЂкЂп B. ЂкЂнЂп C. ЂйЂлЂмЂп D. ЂкЂнЂоЂп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФЭЙтИпаЇЕФФтГ§ГцОеѕЅЯрМЬПЊЗЂГЩЙІЃЌЦфжавЛИіживЊЕФВњЦЗУ№ЩБОеѕЅЕФНсЙЙШчЯТЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A.ИУгаЛњЮяЗжзгЪНЮЊC25H21O3NCl
B.ИУгаЛњЮяжаКЌга3ИіЪжадЬМдзг
C.ИУгаЛњЮяжаЕФЬМдзгдгЛЏЗНЪНЮЊ sp2 Лђ sp3
D.ИУгаЛњЮяПЩвдЗЂЩњЫЎНтЗДгІЁЂМгГЩЗДгІЁЂбѕЛЏЗДгІ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com