
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.NaHCO3溶液:K+、SO42-、Cl-、AlO2-
B.由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.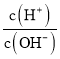 =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
科目:高中化学 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
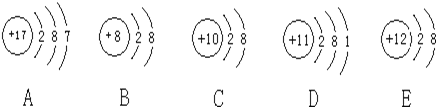
(1)属于离子结构示意图的是______、______(填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同)______,最容易失去电子的原子是______,最容易得到电子的原子是______。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式______。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲烷和氨气相比较,下列结论中错误的是( )
A.两种气体的分子个数之比为17∶16
B.同温同压下,两种气体的体积之比为17∶16
C.两种气体的氢原子个数之比为17∶12
D.同温同压下,两种气体的密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH356. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将_________(填“偏高”、或“偏低”或“不变”)。
(2)氨气常用__________________检验,现象是________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250 mL、0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是( )
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.准确称量1.0 g NaOH进行配制
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图中有机物的说法错误的是( )

A.该有机物的分子式为C8H9O4Br
B.1mol该有机物最多可以与3molH2反应
C.能发生酯化反应、水解反应、氧化反应
D.1mol该有机物与NaHCO3溶液反应时,最多消耗1molNaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
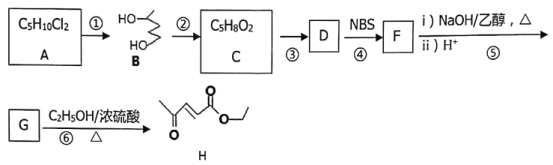
【题目】某香料(H)的一种合成路线如下:
已知:![]()
回答下列问题:
(1)A的系统命名为_____,反应⑤第i)步反应化学方程式为________。
(2)反应②的试剂与条件为:_________,反应①→⑥中属于取代反应的有(填反应编号)____。
(3)D的结构简式为:________。
(4)写出符合下列要求的G的同分异构体结构简式:______。
①具有六元环状结构,不含其他环状结构
②核磁共振氢谱显示只有二种信号峰且二信号峰面积之比为1:2
③不能使溴的四氯化碳溶液褪色
(5)参照上述合成路线,设计以2-甲基丁酸和苯甲醇为原料合成![]() _______。
_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物说法正确的是
A.  与 NaOH的水溶液共热,反应后生成的醇能被氧化为醛
与 NaOH的水溶液共热,反应后生成的醇能被氧化为醛
B. CH3Cl中加入NaOH的水溶液共热,再滴入AgNO3溶液,可检验该物质中含有的卤素原子
C. 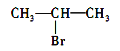 发生消去反应得到两种烯烃
发生消去反应得到两种烯烃
D. CH3Cl、 、
、 中加入 NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成
中加入 NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com