
| 58 |
| 14 |
| 58 |
| 14 |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
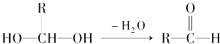
查看答案和解析>>
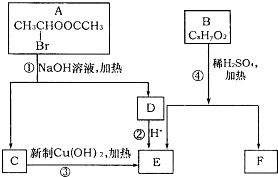
科目:高中化学 来源: 题型:
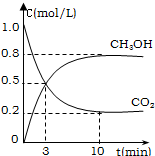 为减小CO2对环境的影响,在限制排放量的 同时,应加强对CO2创新利用的研究.利用CO2在适当条件下合成甲醇和水.在2L的密闭容器中,充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
为减小CO2对环境的影响,在限制排放量的 同时,应加强对CO2创新利用的研究.利用CO2在适当条件下合成甲醇和水.在2L的密闭容器中,充入2mol CO2和6mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、一定是甲烷和乙烯的混合物 |
| D、一定含甲烷,不含乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
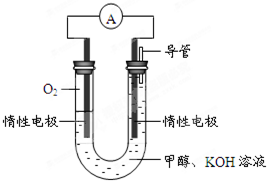 (1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2,
(1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com