
【题目】A~F均为中学化学常见的物质,它们之间存在如下转化关系,其中C和D的稀溶液不反应,B、C与D反应还可生成A(产物水等略去)。下列说法错误的是
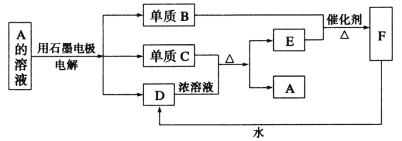
A.铂丝蘸取A溶液灼烧,焰色反应显蓝绿色
B.D的浓溶液有强氧化性
C.E是一种有毒气体,不能用作食品添加剂
D.A的溶液电解时,阳极反应式为4OH--4e-=2H2O+O2↑
科目:高中化学 来源: 题型:
【题目】一定温度下,向某密闭容器中充入1.6 molH2与1.0molCO,发生如下可逆反应并达到平衡:H2(g)+CO(g)C(s)+H2O(g)+Q kJ(Q>0).若压缩容器体积并同时升高温度,达到新平衡后,关于下列物理量的变化情况叙述错误的是( )
A.反应速率可能保持不变
B.平衡常数一定减小
C.混合气体的平均摩尔质量可能减小
D.H2O(g)的体积分数可能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与B是短周期的两种元素,它们的离子![]() 与
与![]() 具有相同的核外电子层结构,则下列说法中正确的是( )
具有相同的核外电子层结构,则下列说法中正确的是( )
A.原子序数A>BB.电子数A>BC.原子半径A>BD.离子半径![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的化工原料,工业上以丙烯为原料可合成高分子化合物F和香料K,其流程如图所示:
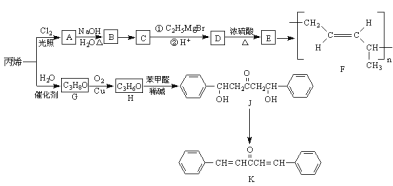
已知: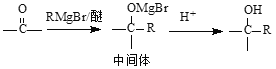 (R为烃基)
(R为烃基)
(1)G的名称为___,J中含氧官能团的名称为___。
(2)由D生成E的反应类型为___;由H生成J的反应类型为___。
(3)已知A中只含有1个氯原子,写出由A生成B的化学方程式___。
(4)由K可合成另外一种香料M(![]() ),M的分子式为___,M的芳香同分异构体中能发生水解反应和银镜反应的有___种,其中核磁共振氢谱有4组峰的同分异构体的结构简式为___。
),M的分子式为___,M的芳香同分异构体中能发生水解反应和银镜反应的有___种,其中核磁共振氢谱有4组峰的同分异构体的结构简式为___。
(5)利用“![]() ”为初始原料合成
”为初始原料合成![]() ,写出合成路线___(其它无机试剂任选)。
,写出合成路线___(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
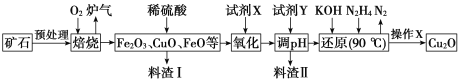
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________(填字母序号)
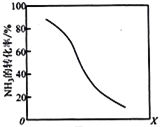
a.温度 b.压强 c.催化剂 d.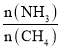
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 与
与![]() 反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得![]() ;③打开K,通入
;③打开K,通入![]() 直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出![]() ;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
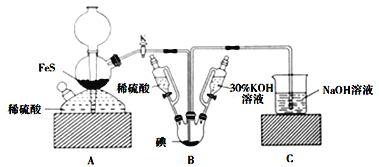
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为![]()
C.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
D.装置C中氢氧化钠溶液的作用是吸收硫化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 K 是某药物的中间体,合成路线如图所示:
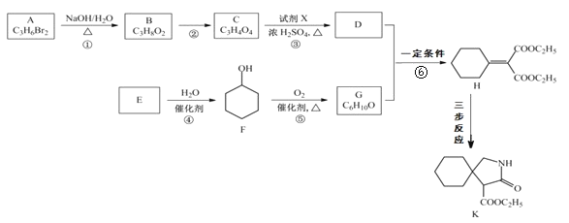
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5(也可写为:NH4H),它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )
A.它与水反应的化学方程式为NH5 + H2O ═ NH3H2O + H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为 
D.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.3 mol·L-1硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图是已提供仪器,配制上述溶液均需用到的玻璃仪器是________(填选项)。
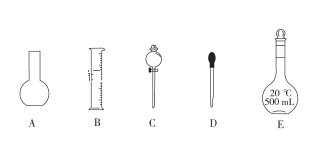
(2) 下列操作会使配制的NaOH溶液浓度偏低的是__________。
A 称量NaOH所用砝码生锈
B 选用的容量瓶内有少量蒸馏水
C 定容摇匀后,液面下降,又加水至刻度线
D 定容时俯视刻度线
(3)根据计算用托盘天平称取NaOH的质量为________g。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com