
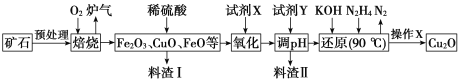
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
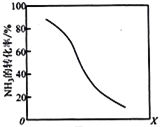
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________(填字母序号)
a.温度 b.压强 c.催化剂 d.
【答案】SO2 2∶1 空气或氧气 3.7≤pH<4.8 ad 4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4K2SO4+6H2O 防止Cu2O被空气中氧气氧化 2Cu-2e-+2OH-=Cu2O+H2O bd
2Cu2O+N2↑+4K2SO4+6H2O 防止Cu2O被空气中氧气氧化 2Cu-2e-+2OH-=Cu2O+H2O bd
【解析】
硫化铜矿石(含 CuFeS2、Cu2S等)预处理后与氧气焙烧:2CuFeS2+4O2 ![]() Cu2S+3SO2+2FeO、Cu2S+2O2
Cu2S+3SO2+2FeO、Cu2S+2O2![]() 2CuO+SO2,部分FeO被氧化为Fe2O3,得到相应的金属氧化物和SO2,加入稀硫酸溶解金属氧化物,得到含有Cu2+、Fe2+、Fe3+的酸性溶液,加入试剂X将Fe2+氧化为Fe3+,加入试剂Y调节pH3.7~4.8沉淀Fe3+,过滤,将滤液用KOH、N2H4还原,反应为:4CuSO4+N2H4+8KOH
2CuO+SO2,部分FeO被氧化为Fe2O3,得到相应的金属氧化物和SO2,加入稀硫酸溶解金属氧化物,得到含有Cu2+、Fe2+、Fe3+的酸性溶液,加入试剂X将Fe2+氧化为Fe3+,加入试剂Y调节pH3.7~4.8沉淀Fe3+,过滤,将滤液用KOH、N2H4还原,反应为:4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4KSO4+6H2O,过滤,洗涤、隔绝空气烘干,制得Cu2O。
2Cu2O+N2↑+4KSO4+6H2O,过滤,洗涤、隔绝空气烘干,制得Cu2O。
(1)根据流程,矿石与氧气高温反应得到金属氧化物和SO2;Cu2S与O2反应为Cu2S+2O2![]() 2CuO+SO2,氧化剂为氧气,还原剂为Cu2S,氧化剂与还原剂的物质的量之比为2:1;
2CuO+SO2,氧化剂为氧气,还原剂为Cu2S,氧化剂与还原剂的物质的量之比为2:1;
(2)若试剂X是H2O2溶液,将Fe2+氧化为Fe3+;酸性条件下,O2也可将Fe2+氧化为Fe3+,而氧气或空气价格远低于过氧化氢,故可用氧气或空气替代;
(3)加入试剂Y的目的是调节pH完全沉淀Fe3+,但不沉淀Cu2+,根据表中数据可知,pH范围为:3.7≤pH<4.8;
(4)还原过程中发生的反应是4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4KSO4+6H2O,提高N2H4的转化率,则N2H4要充分反应;
2Cu2O+N2↑+4KSO4+6H2O,提高N2H4的转化率,则N2H4要充分反应;
a.不断搅拌,增加N2H4与溶液的接触面,使得N2H4充分反应,a符合题意;
b.增大通入N2H4的流速,有部分N2H4来不及反应,转化率会降低,b不符合题意;
c.减少KOH的进入量,该反应需要消耗碱,如果没有碱,反应速率减慢,转化率降低,c不符合题意;
d.减小通入N2H4的流速,能够使得N2H4反应更加充分,转化率增加,d符合题意;
综上ad符合题意;
(5)根据分析N2H4制备Cu2O的化学方程式为4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4KSO4+6H2O;
2Cu2O+N2↑+4KSO4+6H2O;
(6)操作X为过滤,洗涤、隔绝空气烘干,制得Cu2O,因为Cu2O可以被O2氧化,在加热条件下易被空气氧化,故烘干过程要隔绝空气;
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,阳极发生氧化反应,电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O;
(8)根据图示,NH3的转化率随着X的增加而减小;
a该反应为放热反应,升高温度,平衡正向移动,NH3的转化率增加,与图像不符,a不符合题意;
b.该反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,NH3的转化率减小,与图像相符,b符合题意;
c.催化剂增加化学反应速率,但是不影响平衡移动,NH3转化率不变,与图像不符,c不符合题意;
d.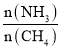 增加,平衡正向移动,但是NH3的转化率减小,与图像相符,d符合题意;
增加,平衡正向移动,但是NH3的转化率减小,与图像相符,d符合题意;
综上bd符合题意。


科目:高中化学 来源: 题型:
【题目】用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外
A.①③④B.②⑤C.②③⑤D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中不能使指定物质或粒子的浓度增大的是( )
A.向AgCl悬浊液中加入少量Na2S固体,使溶液中Cl-浓度增大
B.向新制氯水中加入少量大理石,使HClO浓度增大
C.压缩平衡体系2NO2![]() N2O4的体积,使NO2浓度增大
N2O4的体积,使NO2浓度增大
D.向Fe(NO3)2溶液中,加入少量盐酸抑制Fe2+的水解,使Fe2+浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案:测定某含有NaCl的小苏打样品中![]() 的质量分数。已知:
的质量分数。已知:![]() 受热分解成碳酸钠、二氧化碳和水。
受热分解成碳酸钠、二氧化碳和水。
(方案一)称取一定质量样品,置于仪器A中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)仪器A的名称为___________;A应该放在_________中冷却。恒重操作的目的是________。
(2)本实验从称量空的A仪器开始,完成一次平行实验至少需要称重____次。做平行实验的目的是___________。
(方案二)称取一定质量的样品(样品的质量为m0),置于小烧杯中,加适量水溶解;向小烧杯中加入足量澄清石灰水,过滤,洗涤、干燥,称量沉淀的质量为m1,计算。(已知碳酸钙式量为100,![]() 的式量为84)。
的式量为84)。
(3)反应方程式为_____________,则样品中![]() 的质量分数可以表示为_________。
的质量分数可以表示为_________。
(方案三)往Y形管中注入一定体积和浓度的稀硫酸并放入准确称取的ag样品,连接好注射器(如图),再将Y形管倾斜,使样品与酸液充分反应。
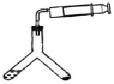
(4)a不能太大,理由是___________,若测定结果偏高,其原因可能是______(选填序号)。
①样品未完全反应
②温度未恒定即记录数据
③少量![]() 溶解在溶液中
溶解在溶液中
(方案四)称取一定质量样品,配成待测溶液,用标准盐酸滴定。
(5)下列叙述正确的是_______(选填序号)。
①用烧杯配制100mL待测溶液
②用酚酞为指示剂
③当滴至待测液变色并能将该颜色保持半分钟即为滴定终点
④盛盐酸的滴定管未润洗会造成实验结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F均为中学化学常见的物质,它们之间存在如下转化关系,其中C和D的稀溶液不反应,B、C与D反应还可生成A(产物水等略去)。下列说法错误的是
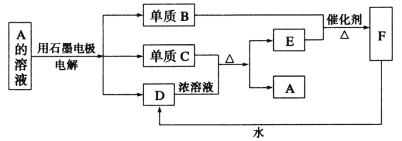
A.铂丝蘸取A溶液灼烧,焰色反应显蓝绿色
B.D的浓溶液有强氧化性
C.E是一种有毒气体,不能用作食品添加剂
D.A的溶液电解时,阳极反应式为4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
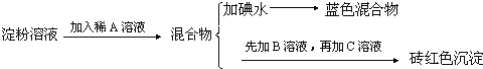
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电渗析法处理含Na2SO4废水,原理如图所示,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子不能进入中间隔室。

下列叙述正确的是( )。
A.当电路中通过2 mol电子的电量时,会有2mol的H2生成
B.负极区得到NaOH,正极区得到H2SO4
C.负极反应为2H2O-4e-=O2+4H+,负极区溶液pH增大
D.通电后中间隔室的SO42-离子向负极迁移,正极区溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20 mL l mol/L的某二元弱酸H2X溶液中逐渐加入NaOH固体(忽略溶液温度及体积变化),测得溶液中的H2X、HX-、X2-的物质的量浓度与溶液pH变化关系如图。下列叙述错误的是( )
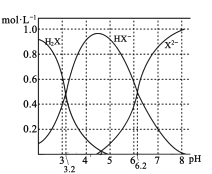
A.NaHX的水溶液呈酸性
B.当加入NaOH固体0.01 mol时,溶液pH= 3.2
C.当加入NaOH固体0.02 mol时,溶液中的离子浓度大小关系为:c(Na+)>c(HX-)>c(H+)>c(X2-)> c(OH-)
D.当加入NaOH固体0.04 mol时,溶液中水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com