
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
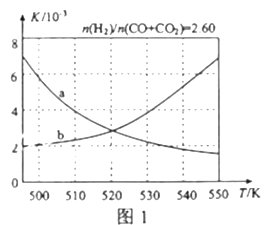
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.
【答案】-99 +41 ![]() a 反应①正反应为放热反应,平衡常数随温度升高而减小
a 反应①正反应为放热反应,平衡常数随温度升高而减小
【解析】
(1)反应热=反应物总键能生成物总键能,故△H1=1076kJ/mol+2×436kJ/mol (3×413+343+465)kJ/mol=99 kJ/mol;
根据盖斯定律:反应②反应①=反应③,故△H3=△H2△H1=58 kJ/mol (99 kJ/mol)=+41 kJ/mol,
故答案为:99;+41;
(2)反应①CO(g)+2H2(g)CH3OH(g)的平衡常数表达式![]() ;
;
反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
故答案为:![]() ;a;反应①正反应为放热反应,平衡常数随温度升高而减小;
;a;反应①正反应为放热反应,平衡常数随温度升高而减小;


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
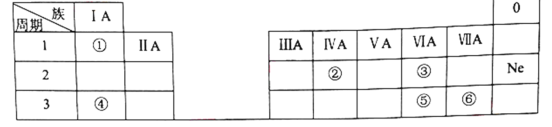
(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于可逆反应的一组是( )
A. 2H2O![]() 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2![]() 2H2O
2H2O
B. NH3+CO2+H2O=NH4HCO3,NH4HCO3![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
C. H2+I2![]() 2HI,2HI
2HI,2HI![]() H2↑+I2↑
H2↑+I2↑
D. 2Ag+Br2![]() 2AgBr,2AgBr
2AgBr,2AgBr![]() 2Ag+Br2
2Ag+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=![]()
③将0.1mol·L-1的NaHS和0.1mol·L-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
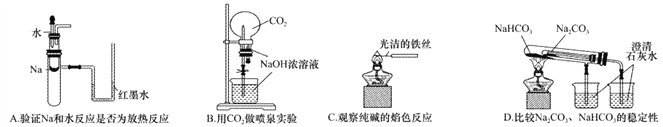
A. A B. B C. C D. D
【答案】D
【解析】A.钠与水反应放热,试管中温度升高,导致气体压强增大,红墨水出现液面差,可以达到实验目的,A正确;B.二氧化碳与氢氧化钠反应,压强减小,形成喷泉,可以达到实验目的,B正确;C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,能够达到实验目的,C正确;D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,题中装置无法达到实验目的,D错误;答案选D。
【题型】单选题
【结束】
18
【题目】下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
A. 氢氧化钠与二氧化碳反应 B. 盐酸和碳酸氢钠溶液
C. 铜与硝酸反应 D. 氯化铝溶液和氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请计算(写出计算过程):
(1)混合气体中NO和NO2的体积各位多少?______________
(2)被还原的硝酸的物质的量为多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是

A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度研究物质的性质是一种行之有效的方法。如图是由铁元素组成的物质的部分信息。

(1)写出X的化学式:___。
(2)FeO与稀硫酸反应的离子方程式:___。Y物质在空气中变化的化学方程式并标出电子转移___。
(3)FeCl2既具有氧化性也具有还原性,分别写出体现其氧化性、还原性的离子方程式(一个即可)。
离子方程式 | |
氧化性 | ___ |
还原性 | ___ |
(4)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了两种试剂进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
化学式 | 溶解性 |
Na2S | 可溶 |
Fe2S3 | 不溶,在热水或酸中分解 |
FeS | 不溶 |
选取的试剂是___和___;可能发生的两种不同原理的反应的离子方程式是__、__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com