
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
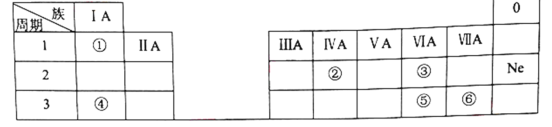
(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
【答案】C < 共价键 Ag++Cl-=AgCl↓
【解析】
根据元素在周期表中的位置分析元素的种类;根据元素周期律及元素性质分析解答。
根据元素周期表的结构及元素在周期表中的位置分析知,①为氢,②为碳,③为氧,④为钠,⑤为硫,⑥为氯;
(1)碳的元素符号是C,故答案为:C;
(2)⑤和⑥处于相同周期,同周期元素随核电荷数增大,非金属性增强,则两种元素的非金属性强弱关系是:⑤<⑥,故答案为:<;
(3)H和O两种元素组成的化合物中有H2O和H2O2,都属于共价化合物,含有的化学键为共价键,故答案为:共价键;
(4)Na和Cl两种元素组成的化合物为NaCl,与AgNO3溶液反应生成氯化银沉淀和硝酸钠,离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是 ( )
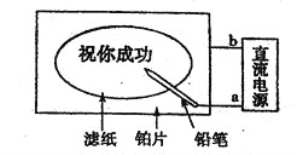
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.a点是负极,b点是正极
D.铅笔端有少量的氯气产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是![]() 与浓硫酸反应的实验装置。已知:铜片足量,浓硫酸(浓度为
与浓硫酸反应的实验装置。已知:铜片足量,浓硫酸(浓度为![]() )为
)为![]() 。下列有关判断正确的是( )
。下列有关判断正确的是( )
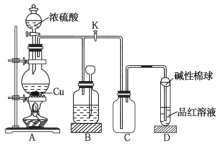
A.装置![]() 中盛装的是浓硫酸,作用是干燥
中盛装的是浓硫酸,作用是干燥![]()
B.装置![]() 为安全瓶,防止装置
为安全瓶,防止装置![]() 中的液体倒吸入装置
中的液体倒吸入装置![]() 中
中
C.品红溶液可检验生成的![]() ,碱性棉球的作用是吸收空气中的酸性气体
,碱性棉球的作用是吸收空气中的酸性气体
D.装置![]() 的作用是收集
的作用是收集![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL 5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
A. Fe2O3B. Fe3O4C. Fe4O5D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3以及一些不反应的不溶性杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:

已知:MnCO3+2NH4Cl![]() MnCl2+CO2↑+2NH3↑+H2O
MnCl2+CO2↑+2NH3↑+H2O
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
开始沉淀时的pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
完全沉淀时的pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
(1)焙烧炉中生成的气体A的成分有__(填化学式)。
(2)气体A可用于制取纯碱,其制取过程如图所示:
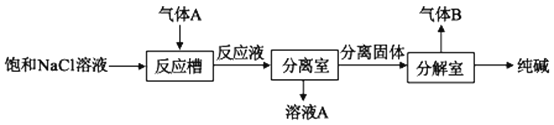
反应槽中有沉淀产生,该沉淀是__(填化学式),生成该沉淀的离子反应方程式为___,气体B的化学式为___。
(3)净化室中的除杂包含三步:
①加入少量MnO2将Fe2+转化为Fe3+,其反应的离子方程式为___;
②加氨水调pH=5.6,生成的沉淀的化学式是__;
③加入适量NH4F,将作为杂质的剩余金属阳离子转化为难溶于水的沉淀除去。
(4)净化液中含有的离子主要有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)工业上常用铝土矿冶炼金属铝。
①铝土矿的主要成分为![]() 和
和![]() ,其中
,其中![]() 属于____________(填“酸性”“碱性”或“两性”)氧化物;
属于____________(填“酸性”“碱性”或“两性”)氧化物;
②冶炼过程中需要用到氨,氨溶于水所得溶液呈____________(填“酸性”或“碱性”);
③利用金属活动性的不同,可以采用不同的冶炼方法,制取单质铝应采取_____________(填“热还原法”或“电解法”)。
(2)工业上合成氨的反应为:![]() ,一定条件下,将
,一定条件下,将![]() 和
和![]() 置于
置于![]() 的密闭容器中,
的密闭容器中,![]() 后测得
后测得![]() 为
为![]() 。
。
①用![]() 表示该反应的速率为___________;
表示该反应的速率为___________;
②其他条件不变时,再通入![]() ,该反应的速率将_____________(填“增大”或“减小”)。
,该反应的速率将_____________(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
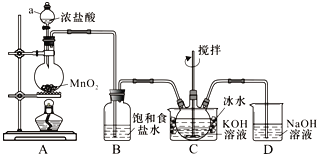
已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯置于冰水浴中,向其中加入________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、AlCl3的混合溶液中,开始滴加试剂X,之后改滴试剂Y,所得沉淀的物质的量n(mol)与试剂体积V(mL)间的关系如图所示。以下结论错误的是( )

A.X是盐酸,Y是NaOH溶液,且c(Y)=2c(X)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5
C.X是NaOH溶液,Y是盐酸,且c(NaOH)∶c(HCl)=2∶1
D.从b至c相应的离子方程式为H++OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
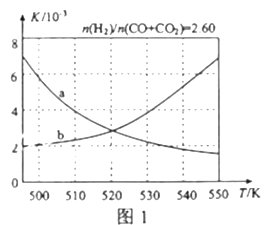
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com