
【题目】某菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3以及一些不反应的不溶性杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:

已知:MnCO3+2NH4Cl![]() MnCl2+CO2↑+2NH3↑+H2O
MnCl2+CO2↑+2NH3↑+H2O
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
开始沉淀时的pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
完全沉淀时的pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
(1)焙烧炉中生成的气体A的成分有__(填化学式)。
(2)气体A可用于制取纯碱,其制取过程如图所示:
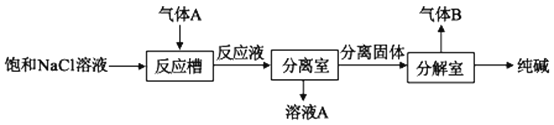
反应槽中有沉淀产生,该沉淀是__(填化学式),生成该沉淀的离子反应方程式为___,气体B的化学式为___。
(3)净化室中的除杂包含三步:
①加入少量MnO2将Fe2+转化为Fe3+,其反应的离子方程式为___;
②加氨水调pH=5.6,生成的沉淀的化学式是__;
③加入适量NH4F,将作为杂质的剩余金属阳离子转化为难溶于水的沉淀除去。
(4)净化液中含有的离子主要有__。
【答案】CO2、NH3和H2O NaHCO3 Na++NH3+CO2+H2O=NaHCO3↓+NH4+ CO2 4H++MnO2+2Fe2+=2Fe3++Mn2++2H2O Al(OH)3和Fe(OH)3 Mn2+、NH4+、Cl-
【解析】
(1)根据已知条件,菱锰矿经氯化铵混合焙烧之后生成CO2和NH3气体,又因反应体系温度过高,水以蒸汽的形式存在,故气体A主要含有CO2、NH3、H2O;
(2)将气体通入NaCl溶液中为侯氏制碱法的方程式,反应方程式为NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓,离子方程为:Na++NH3+CO2+H2O=NaHCO3↓+NH4+,故反应槽中的沉淀为NaHCO3,将固体进入分解室加热,NaHCO3受热分解,生成Na2CO3和CO2,故气体B为CO2;
(3)①向溶液中加入MnO2,在酸性条件下可将Fe2+氧化为Fe3+,方程式为4H++MnO2+2Fe2+=2Fe3++Mn2++2H2O;
②加氨水调节溶液pH,当pH大于离子开始沉淀pH时,这种离子开始生成沉淀,故沉淀为Al(OH)3和Fe(OH)3;
(4)浸取液进入净化室后,调节pH至5.6保证Fe3+、Al3+除尽,加入NH4F将Ca2+、Mg2+除尽,此时溶液中含有的阳离子为Mn2+和NH4+,阴离子为Cl-。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种化合物,它们分别由下列五种原子团的两种不同的基团组成,这五种基团是-CH3,-C6H5,-OH,![]() ,
,![]() 。
。
已知:(1) A是无色晶体,有特殊气味,在空气中易氧化成粉红色;
(2) B、C能发生银镜反应,C的分子量大于B;
(3) D的水溶液与少量氢氧化钠溶液反应,生成-1价的阴离子;与过量氢氧化钠溶液反应,生成-2价阴离子。D可以和A的钠盐反应生成A;
(4) E可以由B氧化制取;
(5) F能氧化成饱和一元醛。
根据上述条件,推断其结构简式分别为:
A____________________B_____________________C_______________
D__________________E_____________________F________________。
上述A、D、E的酸性由强到弱的顺序是_____________________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是 ( )

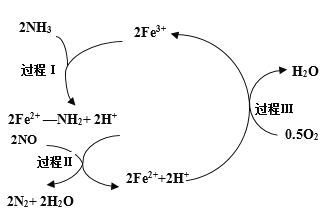
A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硫酸在如图所示装置中发生反应,实验中观察到的现象为![]() 试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀;
试管中溶液变为绿色,试管底部出现黑色和灰白色沉淀;![]() 试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
试管中先出现气泡,短时间内品红溶液无变化,之后溶液的红色逐渐变浅直至褪去。试回答下列问题:
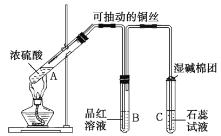
(1)![]() 试管中发生反应的化学方程式为______。
试管中发生反应的化学方程式为______。
(2)![]() 试管中先出现的气泡为______(填名称)。
试管中先出现的气泡为______(填名称)。
(3)实验完毕后取下![]() 试管,______,若溶液______,可证明使品红溶液褪色的物质为
试管,______,若溶液______,可证明使品红溶液褪色的物质为![]() 。
。
(4)![]() 试管中的现象是______。
试管中的现象是______。
(5)湿碱棉团的作用是______。
(6)实验完毕后,待溶液冷却后,取![]() 试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:____________。
试管中上层清液加入水中,发现溶液温度升高。试解释溶液温度升高的原因:____________。
(7)将反应后的沉淀加入水中,黑色沉淀不溶解,灰白色沉淀大部分溶解,溶液变为蓝色,则灰白色沉淀的主要成分为____________。
(8)黑色沉淀可能为![]() 、
、![]() 或
或![]() ,根据所学知识,设计实验验证黑色沉淀中是否含有
,根据所学知识,设计实验验证黑色沉淀中是否含有![]() (已知
(已知![]() 、
、![]() 均为黑色固体,不溶于水和稀硫酸):____________。
均为黑色固体,不溶于水和稀硫酸):____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,收集了如下方案:
操作 | 结论 | |
甲 | 将火柴梗分别放入其中 | 变黑者为浓硫酸 |
乙 | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
丙 | 分别加入盛水的试管中 | 放热者为浓硫酸 |
丁 | 分别在 | 变白者为浓硫酸 |
(1)其中可行的是______
(2)对其中一个操做稍做改进就能成为可行方案的是______,改进方法是______。
(3)请给出另外两种鉴别方案,完成表格。
操作 | 结论 | |
A | __________ | ___________ |
B | ___________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
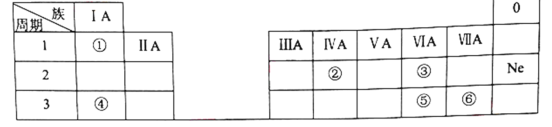
(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。已知: PdCl2溶液可用于检验CO,反应的化学方程式为CO + PdCl2 + H2O= CO2+ 2HCl + Pd(产生黑色金属钯粉末,使溶液变浑浊)。
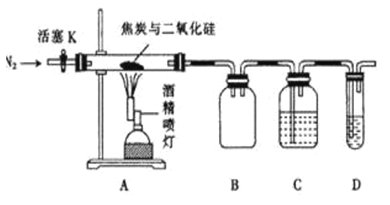
(1)实验时要先通入足够长时间的N2,其原因是_________。
(2) 装置B的作用是__________。
(3)装置C、D所盛试剂分别为______、______,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的总化学方程式为_________。
(4) 该装置的缺点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=![]()
③将0.1mol·L-1的NaHS和0.1mol·L-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A.①④B.②③C.③④D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com