
����Ŀ��ij�о�С���Ա�����ۼ���Ũ�����ϡ����ķ���ʱ���ռ������·�����
���� | ���� | |
�� | ����ֱ�������� | �����ΪŨ���� |
�� | �ֱ���������Ƭ | �����̼�����ζ��ΪŨ���� |
�� | �ֱ����ʢˮ���Թ��� | ������ΪŨ���� |
�� | �ֱ��� | �����ΪŨ���� |
(1)������______
(2)������һ�����������Ľ����ܳ�Ϊ���з�������______���Ľ�������______��
(3)������������ּ�������ɱ���
���� | ���� | |
A | __________ | ___________ |
B | ___________ | __________ |
���𰸡��ס������� �� ���� �ֱ������Ƭ ��������Ƭ�ܽ����ϡ���ᣬ���ܽ����Ũ���� �ֱ���ȡ��ͬ������� ���������Ũ����
��������
����Ũ�����ϡ�������õ��������������ϵIJ��죬�ȿ����Ũ��������Լ���Ҳ�������ϡ��������ʣ����ͨ�ԣ����𣬷�����������
(1)�ף�Ũ�����ܽ���ά���е�H��OԪ����2��1ˮ���ӵ���ʽ��ȥ��������ˮ�ԣ�ϡ����û����ˮ�ԣ�����ȷ��
�ң�Al��ϡ���ᷴӦ����������Ũ������������ۻ����ʴ���
����Ũ����ϡ�����зų��������ȣ�ϡ����û�����Ե���ЧӦ������ȷ��
����Ũ���������ˮ�ԣ�ϡ����û����ˮ�ԣ�����Ũ���ᡢϡ����ֱ�ӵ�CuSO4��5H2O �����У������ΪŨ���ᣬ����ȷ��
�ʴ�Ϊ���ס���������
(2)�ҷ��������������������У��������ܺ�ϡ���ᷴӦ��������������������Ũ����ۻ������ȲŻ���Ũ���ᷴӦ�ų�SO2���Ľ�����Ϊ���ȣ�
(3)��������ϡ�����Ũ������������죬�糣���£�������ϡ���ᷴӦ�ų����������ܽ⣻Ũ������ܶȴ���ϡ���ᣬŨ�������ˮ�Եȣ�����1��������Ƭ����������Ƭ�ܽ����ϡ���ᣬ���ܽ����Ũ�������2���ֱ���ȡ��ͬ������ᣬ���������Ũ�������3�����Գ�����������ϡ�����Ũ���ᣬ¶���ڿ����У��������ӵ���Ũ���ᣬ��֮����ϡ���ᡣ�������ɡ�


 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д� �ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
�ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B������һ�ֽ���Ԫ�غ�һ�ַǽ���Ԫ����ɵĻ����A�н���Ԫ�ص���������Ϊ75%��B��һ�ֵ���ɫ���壬C��J��ͬ����Ԫ�ص���̬�⻯�����C�Ǻ�������ߵ�����XΪ��������ɫҺ�塣��Ӧ���ɵ�ˮ������ȥ����������ͼ��ʾ�Ĺ�ϵ��
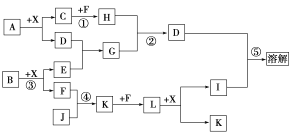
��1��д��B�Ļ�ѧʽ��___��
��2����Ӧ����ÿ����1molF��ת�Ƶ��ӵ���ĿΪ___��
��3����Ӧ�ܵĻ�ѧ����ʽΪ��___��
��4��д������H��G������Ӧ�ڵ����ӷ���ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ӧ�ķ���ʽ��������ǣ� ��
A.��֪��4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H<0�����ȵIJ�˿��NH3��O2������Ӵ�����˿�������ֺ���
B.��֪��2NO2(g)������ɫ��![]() N2O4(g)����ɫ�� ��H<0������NO2������������ˮ�У���ɫ��dz
N2O4(g)����ɫ�� ��H<0������NO2������������ˮ�У���ɫ��dz
C.��H+(aq)+OH-(aq)=H2O(l) ��H=-57.3kJ��mol-1������0.1molHCl�������м���4.0gNaOH���壬�ų�����������5.73kJ
D.����ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-890.3kJ��mol-1��������ȼ����Ϊ890.3kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���50mL0.01mol��L-1��HA��Һ����μ���0.01mol��L-1��MOH��Һ�������ҺpH�ı仯������MOH��Һ�������ϵ��ͼ��ʾ���ܶ����������仯���Բ��ƣ�������˵����ȷ���ǣ� ��
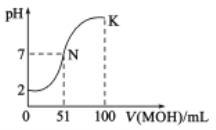
A.��ͼ���ж�HA��ǿ�ỹ������
B.�����Һ��pH=7ʱ��HA��MOHǡ����ȫ��Ӧ
C.K���Ӧ����Һ�У�c(M+)>c(OH-)>c(A-)>c(H+)
D.������MOH��Һ�����Ϊ50mLʱ����Һ�У�c(H+)=c(MOH)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С������ͼװ�ý���SO2��FeCl3��Һ��Ӧ�����ʵ�飨�г�װ������ȥ����
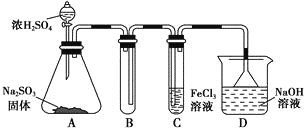
��1���������Ȼ�����Һʱ�����Ȱ��Ȼ��������ܽ���________�У��ټ�ˮϡ�ͣ�����������Ŀ����________�������в���Ҫ��������________��������ȷѡ��ǰ����ĸ����
a��ҩ�ס� b���ձ��� c��ʯ������ d���������� e������
��2��ͨ������SO2ʱ��C�й۲쵽������Ϊ______________________________��
��3��������������С��ͬѧ��ΪSO2��FeCl3��Һ������������ԭ��Ӧ��
��д��SO2��FeCl3��Һ��Ӧ�����ӷ���ʽ��___________________________��
�������ʵ�鷽��������Fe2�����ɣ�__________________________________��
����С��ͬѧ��C�Թܷ�Ӧ�����Һ�м��������ữ��BaCl2��Һ�������ְ�ɫ����������֤����Ӧ������SO42-��������________����������������������������������_______________________________________________________________��
��4��Dװ���е���©����������______________________________________��
��5��Ϊ����֤SO2���л�ԭ�ԣ�ʵ���п��Դ���FeCl3���Լ���________��������ȷѡ��ǰ����ĸ����
a��ŨH2SO4b������KMnO4��Һ
c����ˮ d��NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���̿����Ҫ�ɷ�ΪMnCO3��������������FeCO3��CaCO3��MgCO3��Al2O3�Լ�һЩ����Ӧ�IJ��������ʣ���ҵ�������̿�Ϊԭ���Ʊ��ߴ���̼���̵�������ͼ��ʾ��

��֪��MnCO3+2NH4Cl![]() MnCl2+CO2��+2NH3��+H2O
MnCl2+CO2��+2NH3��+H2O
��ؽ�������[c0(Xn+)=0.1mol��L-1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
��ʼ����ʱ��pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
��ȫ����ʱ��pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
��1������¯�����ɵ�����A�ijɷ���__���ѧʽ����
��2������A��������ȡ�������ȡ������ͼ��ʾ��
��Ӧ�����г����������ó�����__���ѧʽ�������ɸó��������ӷ�Ӧ����ʽΪ___������B�Ļ�ѧʽΪ___��
��3���������еij��Ӱ���������
�ټ�������MnO2��Fe2+ת��ΪFe3+���䷴Ӧ�����ӷ���ʽΪ___��
�ڼӰ�ˮ��pH=5.6�����ɵij����Ļ�ѧʽ��__��
�ۼ�������NH4F������Ϊ���ʵ�ʣ�����������ת��Ϊ������ˮ�ij�����ȥ��
��4������Һ�к��е�������Ҫ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaS�����Ʊ��������������ϵȡ�ij��������������ƺͽ�̿�ڸ����·�Ӧ�Ʊ��Ʋ�������
(1)��ͬѧ�����ͼ��ʾʵ��װ�ü���������
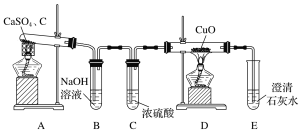
Bװ�õ�������______________________________��D��Eװ���ܼ���װ��A�ķ�Ӧ�����е�________(�ѧʽ)��Eװ���п��ܳ��ֵ�������_________________________________��
(2)��ͬѧ���������������ԭ��Ӧԭ����װ��A�е����������ܻ���CO2��SO2��Ϊ����֤���IJ��룬�������װ�ò�ѡ�������������ʵ�鷽��(ͬһ���������ظ�ʹ��)��
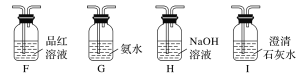
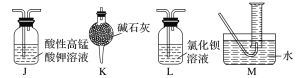
�������������ң���������˳��ΪA��F��__________��
����֤����CO2��������______________________________________________________��
�۳�ȥSO2�����ӷ���ʽΪ___________________________________________________��
(3)��ʵ��������������SO2��CO��CO2���������֮��Ϊ1��1��2��д��A�з�Ӧ�Ļ�ѧ����ʽ��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SiO2�Ʊ��ߴ��ȹ�Ĺ�ҵ������ͼ��ʾ��
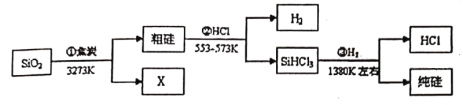
����˵���������
A. SiO2�봿�趼��Ӳ�ȴ��۷е�ߵľ���
B. XΪCO����
C. ��Ӧ�ڲ�����H2�뷴Ӧ�۲�����HCl����ѭ��ʹ��
D. ��Ӧ�٢ڢ۾�Ϊ�ڸ��������µķ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
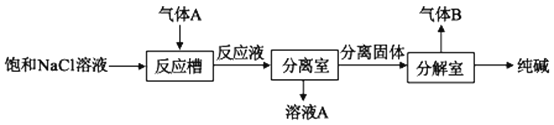
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܶຬ�Ȼ����ﶼ����Ҫ��Ư��
������������(NaClO2)��һ�ֳ���Ư����ij̽��С�鿪չ����ʵ�飬�ش��������⣺
��ȡNaClO2���尴����ͼװ�ý�����ȡ��
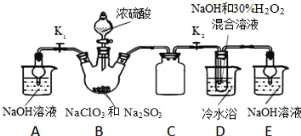
��֪��NaClO2������Һ�ڵ���38��ʱ����NaClO23H2O������38��ʱ����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��
(1)װ��C��������_____________��
(2)��֪װ��B�еIJ�����ClO2���壬��װ��D�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ___________________��װ��B�з�Ӧ�����Һ�������ӳ���ClO2����ClO3����Cl����ClO����OH������ܺ��е�һ����������______����������ӵķ�����____________________��
(3)�벹���װ��D��Ӧ�����Һ�л��NaClO2����IJ������衣
�ټ�ѹ��55�������ᾧ����________������38����60����ˮϴ�ӣ��ܵ���60������õ���Ʒ��
(4)�����ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е�������_______________��
����ClO2Ҳ��һ�ֳ���Ư������ClO2������������ˮ������һ�����к���ClO![]() ���ҹ��涨����ˮ��ClO
���ҹ��涨����ˮ��ClO![]() �ĺ���Ӧ������0.20 mg��L��1���ⶨˮ����ClO2��ClO
�ĺ���Ӧ������0.20 mg��L��1���ⶨˮ����ClO2��ClO![]() �ĺ����Ĺ������£�
�ĺ����Ĺ������£�
����ȡ25.00 mLˮ�����뵽��ƿ�У�������ˮ����pHΪ7.0��8.0��
�ڼ���������KI���塣�˹��̷�����Ӧ2ClO2��2I��===2ClO![]() ��I2��
��I2��
�ۼ�������������Һ������������Һ�еμ�1.00��10��3 mol��L��1 Na2S2O3��Һ����Һ��ɫ�պ���ȥ������Na2S2O3��Һ7.45 mL���˹��̷�����Ӧ��2S2O![]() ��I2===S4O
��I2===S4O![]() ��2I����
��2I����
�ܵ��ڵڢ۲�������Һ��pH��2.0���˹��̷�����ӦClO![]() ��4H����4I��===Cl����2I2��2H2O��
��4H����4I��===Cl����2I2��2H2O��
��������Һ�еμ�1.00��10��3 mol��L��1 Na2S2O3��Һ����ɫ�պ���ȥ������Na2S2O3��Һ30.00 mL
�����������ݼ��㲢�жϸ�ˮ����ClO![]() �ĺ����Ƿ���Ϲ��ҹ涨��
�ĺ����Ƿ���Ϲ��ҹ涨��
______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com