
【题目】CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图所示实验装置检验气体产物。
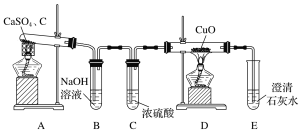
B装置的作用是______________________________;D和E装置能检验装置A的反应产物中的________(填化学式);E装置中可能出现的现象是_________________________________。
(2)乙同学提出,根据氧化还原反应原理,装置A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
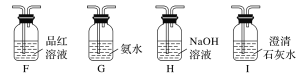
①气流从左至右,仪器连接顺序为A、F、__________。
②能证明有CO2的现象是______________________________________________________。
③除去SO2的离子方程式为___________________________________________________。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:________________________________________________________________________。
【答案】除去酸性气体 CO 溶液变浑浊 J、F、I、M 第2个F中溶液不褪色,I中溶液变浑浊 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 2CaSO4+3C ![]() CaS+CaO+SO2↑+2CO2↑+CO↑
CaS+CaO+SO2↑+2CO2↑+CO↑
【解析】
硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,CuO氧化CO生成红色的Cu和CO2,CO2使石灰水变浑浊。验证A中的气体产物可能还有CO2、SO2,必须先用品红验证SO2后再用酸性高锰酸钾除去SO2,再用澄清石灰水检验CO2,据此分析解答。
(1)硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,因此氢氧化钠溶液可吸收除去酸性气体,但不能吸收CO;通过一氧化碳还原氧化铜由黑色变红色和CO2能够使澄清石灰水变浑浊的现象,证明装置A的反应产物是CO;反应生成的二氧化碳能够使E装置中的澄清石灰水变浑浊,故答案为:除去酸性气体;CO;溶液变浑浊;
(2)①装置A中的气体产物可能还有CO2、SO2,根据装置图,可以通过品红溶液检验二氧化硫,除去二氧化硫后再用澄清石灰水检验二氧化碳,因此气流从左至右的仪器连接顺序为A、F、J、F、I、M,故答案为:J、F、I、M;
②能证明有CO2的现象是第2个F中品红溶液不褪色,I中澄清石灰水变浑浊,故答案为:第2个F中溶液不褪色,I中溶液变浑浊;
③装置J中酸性高锰酸钾将二氧化硫氧化,反应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,反应的化学方程式为2CaSO4+3C ![]() CaS+CaO+SO2↑+2CO2↑+CO↑,故答案为:2CaSO4+3C
CaS+CaO+SO2↑+2CO2↑+CO↑,故答案为:2CaSO4+3C ![]() CaS+CaO+SO2↑+2CO2↑+CO↑。
CaS+CaO+SO2↑+2CO2↑+CO↑。


科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关。下列有关说法不正确的是
A. 在燃煤中加生石灰以减少含硫化合物排放
B. 天然气运输时应悬挂如图所示的标志
C. 面粉生产车间应严禁烟火
D. 金属钠着火时使用泡沫灭火器或水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A(g)和B(g),发生反应:2A(g)+B(g)![]() 2C(g)。一段时间后反应达到平衡状态,反应过程中测定的部分数据如下表所示:
2C(g)。一段时间后反应达到平衡状态,反应过程中测定的部分数据如下表所示:
反应时间/min | n(A)/mol | n(B)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法错误的是()
A.前5min的平均反应速率为v(A)=0.08mol·L-1·min-1
B.降低温度为T2℃时,测得上述反应的平衡常数为20,则正反应为吸热反应
C.保持温度不变,向平衡后的容器中再充入0.2molA(g)和0.2molB(g)时,v(正)>v(逆)
D.相同温度下,若起始时向容器中充入0.2molC(g),达到平衡状态时C的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,收集了如下方案:
操作 | 结论 | |
甲 | 将火柴梗分别放入其中 | 变黑者为浓硫酸 |
乙 | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
丙 | 分别加入盛水的试管中 | 放热者为浓硫酸 |
丁 | 分别在 | 变白者为浓硫酸 |
(1)其中可行的是______
(2)对其中一个操做稍做改进就能成为可行方案的是______,改进方法是______。
(3)请给出另外两种鉴别方案,完成表格。
操作 | 结论 | |
A | __________ | ___________ |
B | ___________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系。
已知:A是气体单质,C 是红棕色气体。

回答下列问题:
(1)写出C的化学式:________;
(2)在上图D→B的过程中,D表现出强_____(填“氧化性”或“还原性”);
(3)写出C→D转化的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图所示),促进了世界制碱技术的发展.下列有关说法正确的是( )
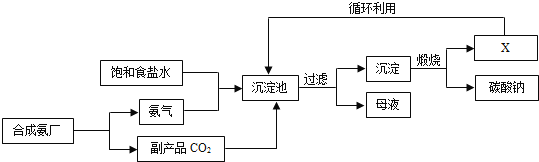
A.沉淀池中的反应物共含有五种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行的![]() 转化时,②中的Fe3+作______________剂;
转化时,②中的Fe3+作______________剂;
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作_____剂,具有__________________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
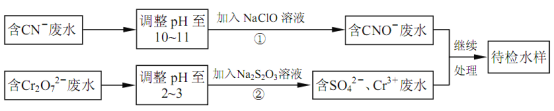
完成下列填空:
(1)HCN有剧毒,电子式是___,其分子属于___(填“极性”、“非极性”)分子。
(2)选用最详尽描述核外电子运动状态的方式,来表示氮原子的最外层电子:___,氮原子核外有___种能量不同的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___。
a.相同条件下水溶液的酸性:HClO3>H2SO3
b.稳定性:HCl>H2S
c.相同条件下水溶液的pH:Na2S>NaCl
d.还原性:S2->Cl-
(4)写出流程②的离子方程式:___。
(5)反应②中,每消耗1.5mol Cr2O72-转移电子的数目为___个。
(6)取少量待检水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,用平衡移动原理解释产生该现象的原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com