
����Ŀ��һ������50kg�Ľ����ˣ�����Լ����2g������2g���������ڲ����Ե��ʵ���ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڡ��������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬Fe2+�������Σ�����������������ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+���������������ա�
��1���������н��е�![]() ת��ʱ�����е�Fe3+��______________����
ת��ʱ�����е�Fe3+��______________����
��2��������ά����C����ʹʳ���е�Fe3+ ��ԭ��Fe2+����仰ָ����ά����C����һ��Ӧ����_____��������__________________�ԡ�
��3���г����۵�ij����Ƭ�к������Ŀ���ϸС�Ļ�ԭ���ۣ���Щ����������θ���������ת���������Σ��˷�Ӧ�����ӷ���ʽΪ______________________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ӧ�ķ���ʽ��������ǣ� ��
A.��֪��4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H<0�����ȵIJ�˿��NH3��O2������Ӵ�����˿�������ֺ���
B.��֪��2NO2(g)������ɫ��![]() N2O4(g)����ɫ�� ��H<0������NO2������������ˮ�У���ɫ��dz
N2O4(g)����ɫ�� ��H<0������NO2������������ˮ�У���ɫ��dz
C.��H+(aq)+OH-(aq)=H2O(l) ��H=-57.3kJ��mol-1������0.1molHCl�������м���4.0gNaOH���壬�ų�����������5.73kJ
D.����ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-890.3kJ��mol-1��������ȼ����Ϊ890.3kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaS�����Ʊ��������������ϵȡ�ij��������������ƺͽ�̿�ڸ����·�Ӧ�Ʊ��Ʋ�������
(1)��ͬѧ�����ͼ��ʾʵ��װ�ü���������
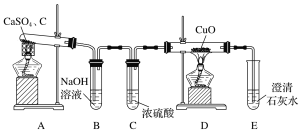
Bװ�õ�������______________________________��D��Eװ���ܼ���װ��A�ķ�Ӧ�����е�________(�ѧʽ)��Eװ���п��ܳ��ֵ�������_________________________________��
(2)��ͬѧ���������������ԭ��Ӧԭ����װ��A�е����������ܻ���CO2��SO2��Ϊ����֤���IJ��룬�������װ�ò�ѡ�������������ʵ�鷽��(ͬһ���������ظ�ʹ��)��
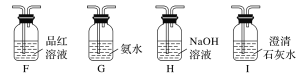
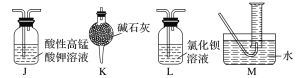
�������������ң���������˳��ΪA��F��__________��
����֤����CO2��������______________________________________________________��
�۳�ȥSO2�����ӷ���ʽΪ___________________________________________________��
(3)��ʵ��������������SO2��CO��CO2���������֮��Ϊ1��1��2��д��A�з�Ӧ�Ļ�ѧ����ʽ��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SiO2�Ʊ��ߴ��ȹ�Ĺ�ҵ������ͼ��ʾ��
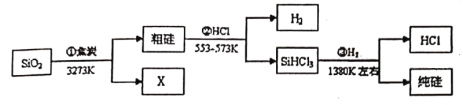
����˵���������
A. SiO2�봿�趼��Ӳ�ȴ��۷е�ߵľ���
B. XΪCO����
C. ��Ӧ�ڲ�����H2�뷴Ӧ�۲�����HCl����ѭ��ʹ��
D. ��Ӧ�٢ڢ۾�Ϊ�ڸ��������µķ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij������Һ�У�����Һ�����������ܼ�������������Һ������������ʵ�Ħ�������������ʵ��ܽ�ȣ�����Һ���ܶȣ������������в�����������ñ�����Һ�����ʵ���Ũ�ȵ��ǣ�������
A.�ܢݢ�B.�٢ڢۢ�C.�٢ڢܢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2��Al2��SO4��3�Ļ����Һ�������в��ϼ���NaOH��Һ���õ����������ʵ��������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������Һ��MgCl2��Al2��SO4��3�����ʵ���Ũ��֮��Ϊ ___________
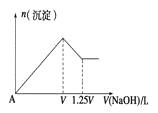
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3+��SO2��ij��ѧ�о���ѧϰС������ͼ��ʾװ�ý���ʵ�飨�г�������A�еļ���װ�����ԣ��������Ѿ�������ϣ���
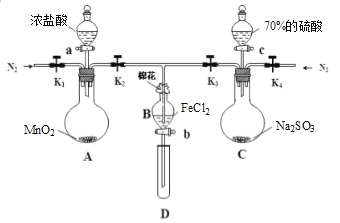
�������ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��������a���μ�һ������Ũ���ᣬ��A������
������B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��������b��ʹԼ2mL����Һ����D�Թ��У��������е���������
�������ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
���������Թ�D���ظ�������������B��Һ�е�������
��1����������Ŀ����__________________________________________________________��
��2�����н������ҺΪ________________��������_____________________________________________ ��
��3��A�з�����Ӧ�Ļ�ѧ����ʽ________________________________________________��
��4�����²���������Һ��Ƶ����ӷ�Ӧ��________________________________________����________��д�Լ���ѧʽ�������������������____________________________________________ ��
��5����˵��������Fe3+��SO2�����ӷ���ʽ��_______________________________��
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������:Cl2��Fe3+��SO2����_______��������������������������
��������B��Һ�к��е����� | ��������B��Һ�к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܶຬ�Ȼ����ﶼ����Ҫ��Ư��
������������(NaClO2)��һ�ֳ���Ư����ij̽��С�鿪չ����ʵ�飬�ش��������⣺
��ȡNaClO2���尴����ͼװ�ý�����ȡ��
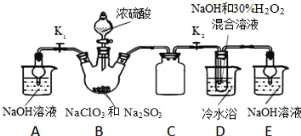
��֪��NaClO2������Һ�ڵ���38��ʱ����NaClO23H2O������38��ʱ����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��
(1)װ��C��������_____________��
(2)��֪װ��B�еIJ�����ClO2���壬��װ��D�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ___________________��װ��B�з�Ӧ�����Һ�������ӳ���ClO2����ClO3����Cl����ClO����OH������ܺ��е�һ����������______����������ӵķ�����____________________��
(3)�벹���װ��D��Ӧ�����Һ�л��NaClO2����IJ������衣
�ټ�ѹ��55�������ᾧ����________������38����60����ˮϴ�ӣ��ܵ���60������õ���Ʒ��
(4)�����ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е�������_______________��
����ClO2Ҳ��һ�ֳ���Ư������ClO2������������ˮ������һ�����к���ClO![]() ���ҹ��涨����ˮ��ClO
���ҹ��涨����ˮ��ClO![]() �ĺ���Ӧ������0.20 mg��L��1���ⶨˮ����ClO2��ClO
�ĺ���Ӧ������0.20 mg��L��1���ⶨˮ����ClO2��ClO![]() �ĺ����Ĺ������£�
�ĺ����Ĺ������£�
����ȡ25.00 mLˮ�����뵽��ƿ�У�������ˮ����pHΪ7.0��8.0��
�ڼ���������KI���塣�˹��̷�����Ӧ2ClO2��2I��===2ClO![]() ��I2��
��I2��
�ۼ�������������Һ������������Һ�еμ�1.00��10��3 mol��L��1 Na2S2O3��Һ����Һ��ɫ�պ���ȥ������Na2S2O3��Һ7.45 mL���˹��̷�����Ӧ��2S2O![]() ��I2===S4O
��I2===S4O![]() ��2I����
��2I����
�ܵ��ڵڢ۲�������Һ��pH��2.0���˹��̷�����ӦClO![]() ��4H����4I��===Cl����2I2��2H2O��
��4H����4I��===Cl����2I2��2H2O��
��������Һ�еμ�1.00��10��3 mol��L��1 Na2S2O3��Һ����ɫ�պ���ȥ������Na2S2O3��Һ30.00 mL
�����������ݼ��㲢�жϸ�ˮ����ClO![]() �ĺ����Ƿ���Ϲ��ҹ涨��
�ĺ����Ƿ���Ϲ��ҹ涨��
______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ�����к���CO��N2��SO2�����壬��Na2SO3��Һ���ղ�����SO2�Ĺ�����ͼ��ʾ��
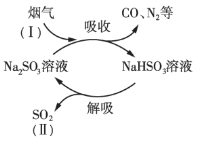
(1)SO2��Ũ�ȣ���______������>������<������
(2)ͼʾ�����п���ѭ�����õ�������______���ѧʽ����
(3)�������չ����з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��______��
(4)����������Ҫ���ȣ�����������г���������SO42-������
��֤�������к�SO42-��ʵ�鷽���ǣ�ȡ�������������Һ��______�������������
�ڲ���SO42-��ԭ����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com