
【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A(g)和B(g),发生反应:2A(g)+B(g)![]() 2C(g)。一段时间后反应达到平衡状态,反应过程中测定的部分数据如下表所示:
2C(g)。一段时间后反应达到平衡状态,反应过程中测定的部分数据如下表所示:
反应时间/min | n(A)/mol | n(B)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法错误的是()
A.前5min的平均反应速率为v(A)=0.08mol·L-1·min-1
B.降低温度为T2℃时,测得上述反应的平衡常数为20,则正反应为吸热反应
C.保持温度不变,向平衡后的容器中再充入0.2molA(g)和0.2molB(g)时,v(正)>v(逆)
D.相同温度下,若起始时向容器中充入0.2molC(g),达到平衡状态时C的转化率为40%
【答案】B
【解析】
A.前5min反应物A的物质的量较少0.8mol,则这段时间内的反应速率v=![]() =0.08mol·L-1·min-1,A正确;
=0.08mol·L-1·min-1,A正确;
B.通过计算可以看出,在10min时和15min时二者数据相同,说明在10min中时反应已经达到平衡,此时反应的化学平衡常数为K=![]() =11.25,T2温度时的平衡常数K=20大于T1温度,说明降低温度平衡向正向移动,正反应为放热反应,B错误;
=11.25,T2温度时的平衡常数K=20大于T1温度,说明降低温度平衡向正向移动,正反应为放热反应,B错误;
C.反应达平衡以后向容器中继续充入A和B,此时的浓度商Q=7.2<K,说明正反应速率大于逆反应速率,C正确;
D.相同温度下,平衡常数不变,此时通入0.2molC物质,平衡时C物质剩余0.12mol,转化率为40%,D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4![]() N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
A.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1
B.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:2
C.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:3
D.从溶液中逸出的气体只有N2,最后留下溶液中溶质只有较多的NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
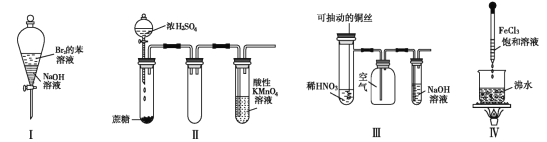
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不相符的是( )
A.已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH<0,灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热
B.已知:2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,将“NO2球”浸泡在冷水中,颜色变浅
N2O4(g)(无色) ΔH<0,将“NO2球”浸泡在冷水中,颜色变浅
C.因H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,故向含0.1molHCl的盐酸中加入4.0gNaOH固体,放出的热量等于5.73kJ
D.甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1,则甲烷的燃烧热为890.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于1mol·L-1的H2C2O4溶液的理解正确的是( )
A.加水稀释过程中,溶液的pH减小
B.c(H2C2O4)+c(HC2O4-)+c(C2O42-)=1mol·L-1
C.溶液中,1mol·L-1<c(H+)<2mol·L-1
D.溶液中,H2C2O4电离出的c(H+):c(C2O42-)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50mL0.01mol·L-1的HA溶液中逐滴加入0.01mol·L-1的MOH溶液,混合溶液pH的变化与所加MOH溶液的体积关系如图所示(密度引起的体积变化忽略不计),下列说法正确的是( )
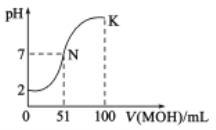
A.由图无法判断HA是强酸还是弱酸
B.混合溶液的pH=7时,HA与MOH恰好完全反应
C.K点对应的溶液中,c(M+)>c(OH-)>c(A-)>c(H+)
D.当加入MOH溶液的体积为50mL时,溶液中:c(H+)=c(MOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
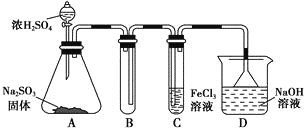
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图所示实验装置检验气体产物。
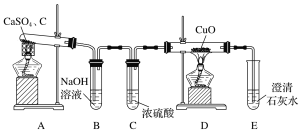
B装置的作用是______________________________;D和E装置能检验装置A的反应产物中的________(填化学式);E装置中可能出现的现象是_________________________________。
(2)乙同学提出,根据氧化还原反应原理,装置A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
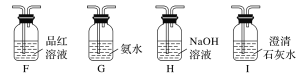
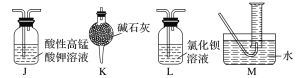
①气流从左至右,仪器连接顺序为A、F、__________。
②能证明有CO2的现象是______________________________________________________。
③除去SO2的离子方程式为___________________________________________________。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
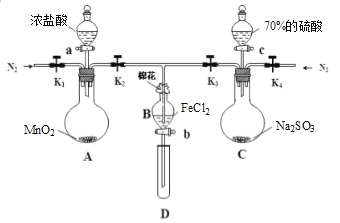
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________________________________。
(2)棉花中浸润的溶液为________________,作用是_____________________________________________ 。
(3)A中发生反应的化学方程式________________________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是________________________________________,用________(写试剂化学式)检验氧化产物,现象是____________________________________________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是_______________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com