
【题目】某化学小组在实验室制取Na2O2。查阅资料可知,钠与空气在453~473 K之间可生成Na2O,迅速提高温度到573~673 K之间可生成Na2O2,若温度提高到733~873 K之间Na2O2可分解。除Li外其他碱金属不与N2反应。

(1)甲组设计制取Na2O2装置如图。
①使用该装置制取的Na2O2中可能含有的杂质为________。
A.Na3N B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如下:

烧瓶中发生的主要反应的化学方程式是______________________。分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果________(填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是________。
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果________(填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案 | 产生的现象 |
Ⅰ.取烧瓶中的反应液加入少量MnO2粉末 | 有大量气泡逸出 |
Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液先变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是____(填实验序号)。根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是____________________。
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度。请简述实验操作和需要测定的有关数据_________________________________________________________________。
【答案】BCD 2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O 偏大 aedfgh(或aedh) 偏小 Ⅰ 碱性条件 称取一定质量的样品(m),加热到733~873 K使之分解,使用量气装置测定常温常压下生成O2体积(V),然后进行有关计算[或称取一定质量的样品(m),加入少量MnO2固体,再加入足量水并使用量气装置测定常温常压下生成O2体积(V),然后进行有关计算]
【解析】
试题(1)①由于空气中含有少量的二氧化碳和水蒸气,因此钠与空气反应时产物中可能含有Na2CO3和NaOH,当反应温度在453~473K之间还有Na2O生成,故选bcd;
②过氧化钠与水反应生成氢氧化钠和氧气,氢氧化钠能够与硫酸反应,烧瓶中发生的主要反应的化学方程式为2Na2O2+ 2H2SO4= 2Na2SO4+ O2↑+ 2H2O;若没有该导管,由于硫酸的流入,会使得收集的气体(含有部分空气)体积偏大,导致测定结果偏大;根据①的分析,需要将生成的二氧化碳除去后再收集氧气,从左至右的连接顺序为aedfgh(或aedh) ,增加澄清石灰水是检验二氧化碳是否除净,故答案为:2Na2O2+ 2H2SO4= 2Na2SO4+ O2↑+ 2H2O;偏大;aedfgh(或aedh) ;
(2)从反应历程上看,过氧化钠与水反应生成过氧化氢,如果过氧化氢没有完全分解,将会导致放出的氧气偏少,测定结果偏小;为了使过氧化氢分解,可以进入少量MnO2粉末,作为催化剂,使过氧化氢完全分解,故选I;根据实验Ⅲ可知,过氧化氢与酚酞作用的条件是碱性条件,故答案为:偏小;Ⅰ;碱性条件;
(3)根据钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解,可以称取一定质量的样品(m),加热到733-873K使之分解,使用量气装置侧定常温常压下生成O2体积(V).然后进行有关计算,也可以称取一定质量的样品(m),加入少量MnO2固体,再加入足量水并使用量气装置测定常温常压下生成O2体积( V),然后进行有关计算,故答案为:称取一定质量的样品(m),加热到733-873K使之分解,使用量气装置侧定常温常压下生成O2体积(V).然后进行有关计算。[或称取一定质量的样品(m),加入少量MnO2固体,再加入足量水并使用量气装置测定常温常压下生成O2体积( V),然后进行有关计算]。


科目:高中化学 来源: 题型:
【题目】某溶液中只可能含 Na+、K+、NH4+、Mg2+、Cu2+、SO32﹣、SO42﹣和 Cl﹣中的几种。将试样平均分成甲、乙、丙各 100mL 三份,每次均加入足量的试剂,设计如下实验。

已知:SO32﹣+Br2+H2O=SO42﹣+2Br﹣+2H+
下列说法正确的是( )
A.溶液中可能含有 Na+、K+、Cu2+
B.溶液中一定含有 Cl﹣、SO42﹣和 Mg2+,且 c(Cl ﹣)=0.2 molL﹣1
C.可能存在的阳离子可用焰色反应进一步检验确认
D.溶液中一定不含 Na+、K+、NH4+、Cu2+、SO32﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。
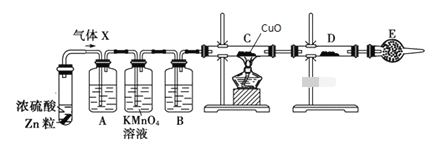
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为__________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)A中加入的试剂可能是______,作用是__________;B中加入的试剂可能是__________,作用是_______;E中加入的试剂可能是__________,作用是__________。
(4)可以证明气体X中含有氢气的实验现象:C中__________,D中__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、SO32-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )

A.该溶液X中可能有Fe3+、Na+
B.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在SO42-、SO32-中的某一种
C.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:
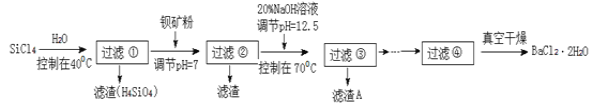
已知:①常温下Fe3+ 、Mg2+ 完全沉淀的 pH 分别是3.4、12.4。
②Ge与Si同主族位于Si的下一周期。
(1)Ge的原子序数________
(2)请用电子式表示C2H2的形成过程_____________________________。
(3)SiCl4发生水解反应的化学方程式____________________________。
(4)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式_____________________________________。
(5)加钡矿粉调节pH=7的作用是:①使BaCO3转化为BaCl2;②________________________
(6)生成滤渣A的离子方程式:______________________________;
(7)BaCl2滤液经__________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(8)10 吨含78.8% BaCO3的钡矿粉理论上最多能生成 BaCl2·2H2O___________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.02 mol·L-1HA溶液和0.01 mol/LNaOH溶液等体积混合,向所得溶液中滴加酚酞试液,溶液显红色,下列关系正确的是
A. c(HA) + c(A-) = 0.02 mol·L-1 B. c(A-)>c(Na+)
C. 2c(H+) = c(A-) - c(HA) D. c(HA)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①2C(s)+O2(g)===2CO(g) ΔH1=-221.0 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=-483.6 kJ·mol-1
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g),ΔH为
A. +262.6 kJ·mol-1 B. -131.3 kJ·mol-1
C. -352.3 kJ·mol-1 D. +131.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com