
【题目】已知①2C(s)+O2(g)===2CO(g) ΔH1=-221.0 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=-483.6 kJ·mol-1
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g),ΔH为
A. +262.6 kJ·mol-1 B. -131.3 kJ·mol-1
C. -352.3 kJ·mol-1 D. +131.3 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室制取Na2O2。查阅资料可知,钠与空气在453~473 K之间可生成Na2O,迅速提高温度到573~673 K之间可生成Na2O2,若温度提高到733~873 K之间Na2O2可分解。除Li外其他碱金属不与N2反应。

(1)甲组设计制取Na2O2装置如图。
①使用该装置制取的Na2O2中可能含有的杂质为________。
A.Na3N B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如下:

烧瓶中发生的主要反应的化学方程式是______________________。分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果________(填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是________。
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果________(填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案 | 产生的现象 |
Ⅰ.取烧瓶中的反应液加入少量MnO2粉末 | 有大量气泡逸出 |
Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液先变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是____(填实验序号)。根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是____________________。
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度。请简述实验操作和需要测定的有关数据_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最终不能生成三价铁的是( )
A.少量Fe与足量稀HNO3反应B.铁丝在硫蒸气中燃烧
C.Fe(OH)2露置于空气中D.向FeBr2溶液中通入足量Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的溶液中,反应FeCl3+3KSCN![]() Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是
Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是
A. 加水稀释 B. 加入少量FeCl3固体
C. 加入少量KCl溶液 D. 加入少量氢氧化钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法正确的是
A. 由“C(s,石墨)―→C(s,金刚石) ΔH=+119 kJ·mol-1”可知金刚石比石墨稳定
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l) ΔH=+285.8 kJ·mol-1
C. 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
D. 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有下列混合气体的量筒倒立于水槽中,充分反应后,无气体剩余,则原混合气体不可能是( )
A.NO2和O2B.NO和O2C.Cl2和SO2D.NH3和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示的实验装置A加热Cu(NO3)2固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色

(1)装置A发生反应中氧化产物与还原产物的体积比是___________(相同条件下)。
(2)装置B的作用是___________,反应一段时间后,将带火星的木条放入B中,木条复燃,说明该红棕色气体可助燃,原因是______________________。
(3)已知NO2和NaOH溶液反应可生成两种钠盐,装置C中发生的离子方程式为_________。
(4)将反应后试管中的固体加水充分溶解、过滤、洗涤,向滤渣中加入一定量稀硫酸,发现固体全部溶解,得到蓝色溶液,分为两份。
①一份溶液经___________、___________、___________、洗涤得蓝色晶体。
②另一份取20mL溶液,加入过量KI,充分反应后,用0.5000mol·L-1的Na2S2O3溶液来滴定反应产物,终点时消耗Na2S2O3溶液40.00mL,则上述溶液中c(Cu2+)=___________ mol·L-1。(已知2Cu2++4I-=2CuI↓+I2;I2+2S2O32-=21-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )

A.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B.Q的最高价氧化物的水化物的酸性比Z的强
C.X氢化物的稳定性比Q强
D.Y的原子半径比X的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:
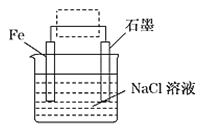
①写出石墨电极的电极反应式____________。
②该装置作简单修改即可成为钢铁电化学防护的装置,请在图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向____________。
③写出修改后石墨电极的电极反应式________________。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_______________________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意如图:

①A电极对应的金属是________(写元素名称),B电极的电极反应式是_______。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com