
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:
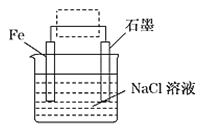
①写出石墨电极的电极反应式____________。
②该装置作简单修改即可成为钢铁电化学防护的装置,请在图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向____________。
③写出修改后石墨电极的电极反应式________________。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_______________________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意如图:

①A电极对应的金属是________(写元素名称),B电极的电极反应式是_______。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为______mol。
【答案】O2+4e-+2H2O=4OH-![]() 2Cl--2e-=Cl2↑2FeCl3+Fe=3FeCl2铜Cu2++2e-=Cu0.08
2Cl--2e-=Cl2↑2FeCl3+Fe=3FeCl2铜Cu2++2e-=Cu0.08
【解析】
(1)①氯化钠溶液呈中性,在中性溶液中钢铁发生吸氧腐蚀,铁易失电子作负极,则石墨作正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-;
②作电解池阴极的铁被保护,所以将虚线中改为直流电源,且将铁连接原电池负极,这属于外加电源的阴极保护法,电子由负极经外电路流向正极,图示为![]() ,故答案为:
,故答案为:![]() ;
;
③外加电源后石墨电极为阳极,阳极上氯离子失电子生成氯气,电极反应式为:2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑;
(2)铁锈的主要成分为氧化铁的水合物,与盐酸反应后生成了Fe3+,而后Fe与Fe3+会化合生成Fe2+,反应方程式为2FeCl3+Fe═3FeCl2,故答案为:2FeCl3+Fe═3FeCl2;
(3)①电镀时,镀层铜作阳极,镀件铁作阴极,所以A是铜,B是铁,阴极上铜离子得电子生成铜,电极反应式为Cu2++2e-═Cu,故答案为:铜;Cu2++2e-═Cu;
②阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为5.12g,二者质量差的一半为阴极析出的铜,则转移电子的物质的量=![]() ×2=0.08mol,故答案为:0.08。
×2=0.08mol,故答案为:0.08。


科目:高中化学 来源: 题型:
【题目】已知①2C(s)+O2(g)===2CO(g) ΔH1=-221.0 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=-483.6 kJ·mol-1
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g),ΔH为
A. +262.6 kJ·mol-1 B. -131.3 kJ·mol-1
C. -352.3 kJ·mol-1 D. +131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
溶液的pH | 加入盐酸的总体积 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或化学用语正确的是( )
A.146C原子中质子数为6、中子数为14
B.16O2与18O2是两种不同的核素
C.23Na+和24Mg2+具有相同的中子数和电子数
D.S2-的结构示意图: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是( )

A. 该溶液X中Na+、Cl-一定有
B. 溶液Y中加入氯化钡溶液没有沉淀
C. 该溶液可能是硫酸亚铁、碘化钾和氯化钠溶于水后得到的
D. 原溶液X中滴加几滴KSCN溶液后,再滴加少量的次氯酸钠溶液后溶液呈血红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小。有关下述两种电池说法正确的是( )

锂离子电池的总反应为:LixC+Li1-xCoO2![]() C+LiCoO2
C+LiCoO2
锂硫电池的总反应为:2Li+S![]() Li2S
Li2S
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.右图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关环境污染的下列说法中,不正确的是 ( )
A.焚烧废旧塑料是减少“白色污染”的有效方法B.氟氯烃能破坏大气臭氧层
C.从保护环境考虑,未来最理想的燃料是氢气D.SO2是大气的主要污染物之一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com