
【题目】请认真观察下图,然后回答问题:

(1)图中所示反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=______(用含E1、E2的代数式表示)。
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多, 反应速率明显加快,你认为最可能的原因是_________________________________________________________。
(3)甲醇(CH3OH)广泛用作燃料电池的燃料,可由天然气来合成,已知:①2CH4(g)+O2(g)===2CO(g)+4H2(g)ΔH=-71 kJ·mol-1②CO(g)+2H2(g)===CH3OH(l)ΔH=-90.5 kJ·mol-1③CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890 kJ·mol-1,则甲醇的燃烧热为________。
【答案】放热 (E2-E1)kJ/mol 使用了催化剂 764 kJ·mol-1
【解析】
(1)根据图像分析,反应的焓变=生成物的能量-反应物的能量;
(2)催化剂能使反应的活化能降低但焓变不变,平衡不移动;
(3)根据盖斯定律进行计算。
(1)依据图象分析,反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量,所以△H=(E2-E1)kJ/mol;
故答案为:放热,(E2-E1)kJ/mol。
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低但焓变不变,平衡不动,化学反应速率的影响因素中,催化剂有此作用,所以最有可能使用了催化剂;
故答案为:使用了催化剂。
(3)根据盖斯定律,(③×2-①)÷2得:CO(g)+2H2(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-854.5 kJ·mol-1④,④-②得:CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764 kJ·mol-1,故甲醇的燃烧热为764 kJ·mol-1。
故答案为:764 kJ·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
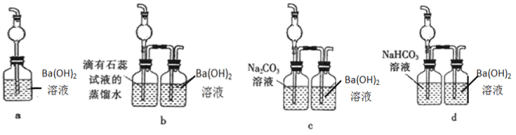
【题目】下图是一个实验室制取氯气并以氯气为原料进行一系列反应的装置,回答下列问题。(已知:①MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑,②Cl2+SO2+2H2O=2HCl+H2SO4,③ Ba(OH)2+CO2=BaCO3↓+H2O)
MnCl2+2H2O+Cl2↑,②Cl2+SO2+2H2O=2HCl+H2SO4,③ Ba(OH)2+CO2=BaCO3↓+H2O)

(1)写出a仪器的名称___;
(2)装置D产生白色沉淀现象的原因___________;
(3)E装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl。试写出E中反应的化学方程式_______;
(4)F处的烧杯溶液中最终___(填“有”或“没有”)白色沉淀;
(5)F装置无法确认E处反应中有CO2产生,为了证明CO2的存在,要对F装置进行改造,下列装置符合要求的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100.0 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到16.84g沉淀,用过量稀硝酸处理后沉淀质量减少至6.99g,同时溶液中有气泡产生。试求:
(1)原混合液中Na2SO4的物质的量浓度为_____;
(2)产生的气体在标准状况下的体积为多少__________?(要求写出计算过程,只写结果不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2) 以KOH溶液为电解质溶液,依据题(1)所选反应设计一个原电池,其负极的电极反应式为_______。

(3) 电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为___________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的c(H+) = _____(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大量排放氮的氧化物会产生酸雨、光化学烟雾等环境问题,工业上常用天然气还原法处理氮的氧化物。
(1) CH4催化还原NO 、NO2的热化学方程式如下:
序号 | 热化学方程式 |
① | 4NO2(g)+ CH4 (g) |
② | 4NO(g)+ CH4 (g) |
则4NO(g)![]() N2(g) +2NO2(g)的ΔH=___________________。
N2(g) +2NO2(g)的ΔH=___________________。
(2)T1℃时,在一密闭容器中发生反应4NO(g)![]() N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
序号 | c(NO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.10 | 4.00×10-9 |
② | 0.20 | 6.40×10-8 |
③ | 0.30 | 3.24×10-7 |
则n=_____________,k正=________________mol-3·L3·S-1。达到平衡后,若减小压强,则混合气体的平均相对分子质量将_______________(填“增大”、“减小”或“不变”)。
(3)利用测压法在刚性密闭容器中研究T2℃时4NO(g)![]() N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
反应时间/min | 0 | 10 | 20 | 30 | 40 |
压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
①20 min时,NO的转化率α =____________﹪。
②T2℃时4NO(g)![]() N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是

A. 两步反应的ΔH均大于0 B. 加入催化剂能改变反应的焓变
C. 三种物质中C最稳定 D. A→C反应的ΔH=E4-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com