
����Ŀ��(1)��ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���__________��
A��C(s)+H2O(g)=CO(g)+H2(g) ��H>0
B��2H2(g)+O2(g)=2H2O(1) ��H<0
C��NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) ��H<0
(2) ��KOH��ҺΪ�������Һ�������⣨1����ѡ��Ӧ���һ��ԭ��أ��为���ĵ缫��ӦʽΪ_______��

(3) ���ԭ���ڻ�ѧ��ҵ�����Ź㷺��Ӧ�á��ֽ�����Ƶ�ԭ���ͨ����������ͼ�е�������������aΪ���Һ��X��Y��Ϊ���Ե缫����
����aΪCuSO4��Һ������ʱ�Ļ�ѧ��Ӧ����ʽΪ___________________��
������⺬��0.04molCuSO4��0.04molNaCl�Ļ����Һ400ml������������������672 mL����״���£�ʱ����Һ��c��H+�� = _____�����������Һ������䣩��
���𰸡�B H2 - 2eһ + 2 OHһ= 2 H2O 2CuSO4+2H2O![]() 2Cu+O2+2H2SO4 0.1mol/L
2Cu+O2+2H2SO4 0.1mol/L
��������
��1������ԭ���ԭ���������Ϣ֪������Ƴ�ԭ��صķ�Ӧ�����Ƿ��ȵ�������ԭ��Ӧ��
��2����KOH��ҺΪ�������Һ������ȼ�ϵ���У������������õ��Ӻ����������ӷ�Ӧ����ˮ��
��3���ؼ�����ȷ���ԭ�����ر�����Һ�����ӵķŵ�˳����
��1������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ���ұ��������Է����е�������ԭ��Ӧ��
A.�÷�Ӧ�����ȷ�Ӧ�����Բ�����Ƴ�ԭ��أ���A����
B.�÷�Ӧ�Ƿ��ȷ�Ӧ�����Է��Ľ���������ԭ��Ӧ����������Ƴ�ԭ��أ���B��ȷ��
C.�÷�Ӧ����������ԭ��Ӧ�����Բ�����Ƴ�ԭ��أ���C����
��ѡB��
��2������Ӧ2H2(g)+O2(g)=2H2O(1) ��H<0����Ƴ�ԭ��أ��õ��Ϊȼ�ϵ�ء�����ԭ���ԭ��������������������Ӧ��������������ԭ��Ӧ��ȼ��H2�ڸ�������Ӧ����ȼ��O2���������μӷ�Ӧ�������KOH��ҺΪ�������Һ���为���缫��ӦʽΪ��H2 - 2e- + 2 OH-= 2 H2O���ʴ�Ϊ��H2 - 2e- + 2 OH-= 2 H2O��
��3���ٵ������ͭ��Һʱ����������������������������ͭ��ͬʱ��Һ���������ᣬ���Ե�ط�ӦʽΪ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4���ʴ�Ϊ��2CuSO4+2H2O
2Cu+O2��+2H2SO4���ʴ�Ϊ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��
2Cu+O2��+2H2SO4��
����⺬��0.04mol CuSO4��0.04mol NaCl�Ļ����Һ400mL�����������������ӷŵ磬�����������������Һ�е�OH���ŵ磬�������������������ӵ����ʵ�����0.04mol��������ȫ�ŵ磬�����������0.02mol����״���µ������448mL��������ʵ��������������Ϊ672mL�������бض��������������ʵ�����0.01mol����Ӧ�й�ת�Ƶ��ӵ����ʵ�����0.08mol������������ͭ���ӷŵ磬�������Һ�е������ӷŵ硣0.04molͭ����ǡ�õõ�0.08mol���ӣ�����0.04mol����ͭ�����Ե�����Һ�е�������0.02mol�����ƺ�0.02mol���ᣬ����Һ�������ӵ�Ũ����0.04mol��0.4L��0.1mol/L���ʴ�Ϊ��0.1mol/L��


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����12C��Ϊȷ��ԭ�����ı�������12C��ԭ������Ϊ24�����涨��24g12C����̼ԭ������Ϊ����٤����������NA��ʾ����������������ȷ���ǣ�������
A.12g̼������ȫȼ����Ҫ���ԼΪ11.2L����״����������
B.44gCO2��28gCO������ͬ��Ŀ�ķ���
C.NA�������Ӻ�1mol����ӵ�����֮��Ϊ8��1
D.������Ħ������Ϊ64g/mol������32g��������������ĿΪ3.01��1025��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʯ(Fe2O3)Ϊ��ʼ�����һϵ�з�Ӧ���Եõ�Fe3[Fe(CN)6]2��Fe(SCN)3����ش��������⣺
(1)д��Fe��ԭ�ӽṹʾ��ͼ_____________________��Oԭ�Ӻ�����ӹ����ʾʽΪ______��
(2)KSCN�Ǽ���Fe3+���Լ�֮һ����SCN-��Ϊ�ȵ������һ�ַ���Ϊ__________����ͼ��SCN��Fe3+�γɵ�һ�������ӣ��������������е���λ��(�Լ�ͷ��ʾ)_______��
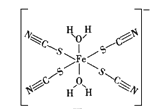
(3)K3[Fe(CN)6]������Fe3+��CN֮��ļ���Ϊ__________���û�ѧ���ܹ��γɵ�ԭ����_______��
(4)K3[Fe(CN)5NO]�����Ԫ���У����ڵڶ����ڵ�Ԫ�صĵ�һ��������С�����˳����_____���������ԭ��������С��Ԫ������Ԫ���γɵ���Է�������Ϊ92�ķ��㻯�����У�����ԭ�ӵ��ӻ����������_________��
(5)������ͨ���Ѫ��(K4[Fe(CN)6])��Һ�У��õ���Ѫ��(K3[Fe(CN)6])��д���ñ仯�Ļ�ѧ����ʽ______��
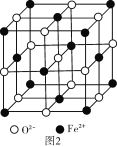
(6)FeO�����ṹ��ͼ2��ʾ��FeO������Fe2+��λ��Ϊ____�����þ����߳�Ϊacm����þ����ܶ�Ϊ___g/cm3(����٤��������ֵΪNA)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������ýṹ���Ƶ�C60��Si60�ϳ������ƹ���Ʒ��������ͼ��ʾ��������̼�軯����Si60C60��������ԭ����������ԭ��ͨ�����ۼ���ϡ�����˵��һ����ȷ����

A.��������̼���裨SiC����Ϊͬ��������
B.�����ʽṹ�У�������ΪC60���ڲ����ΪSi60
C.�������γɵľ����Ƿ��Ӿ���
D.�����ʵ��۵�ߡ�Ӳ�ȴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������۲���ͼ��Ȼ��ش����⣺

(1)ͼ����ʾ��Ӧ��_____(��������������������)��Ӧ���÷�Ӧ����H��______(�ú�E1��E2�Ĵ���ʽ��ʾ)��
(2)����ͬһ��Ӧ,ͼ������(��)��ʵ��(��)���,��ܴ��,����ӵİٷ�������, ��Ӧ�������Լӿ죬����Ϊ����ܵ�ԭ����_________________________________________________________��
(3)�״�(CH3OH)�㷺����ȼ�ϵ�ص�ȼ�ϣ�������Ȼ�����ϳɣ���֪����2CH4(g)��O2(g)===2CO(g)��4H2(g)��H����71 kJ��mol��1��CO(g)��2H2(g)===CH3OH(l)��H����90.5 kJ��mol��1��CH4(g)��2O2(g)===CO2(g)��2H2O(l)��H����890 kJ��mol��1����״���ȼ����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ�������Ϊ100 mL��Ũ�Ⱦ�Ϊ0.1 mol��L��1������һԪ��MOH��ROH����Һ�У��ֱ�ͨ��HCl���壬lg[c(OH-)/c(H+)]��ͨ��HCl�����ʵ����ı仯��ͼ��ʾ�������й�˵���в���ȷ����(��������Һ����ı仯)

A. a����ˮ���������c(H+)��c(OH��)�ij˻���1��10��26
B. b����Һ�У�c(Cl��)��c(R��)��c(H��)��c(OH��)
C. c����Һ��Һ��pH��7������������ΪROH��RCl
D. ���ԣ�MOH��ROH����MOH��ǿ�ROH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���ͬѧ������ʵ�������Ʊ�Na2CO3����ƵIJ���װ����ͼ��ʾ��

����������ȷ����
A. ��XΪŨ��ˮ��YΪ��ʯ���������װ�ü���ȡNH3
B. ��Ӧ������װ�����з�������Ӧ������װ�ö��з���
C. ����װ�ñ����й��˲���
D. ��ĸҺ�������պ�ɵõ�NH4Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A(g) + B(g)3C(g) + 4D(g)�У���ʾ�÷�Ӧ����������
A. v(A)=0.05 mol/(L��S)
B. v(B)=0.3 mol/(L��min)
C. v(C)=1.2 mol/(L��min)
D. v(D)=0.6 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����ʹ��Ӧ���ʼӿ����
�����ӷ�Ӧ������ʵ������������¶� ����С��Ӧ���������
������������ ������MnO2
A. ȫ�� B. �٢ڢ� C. �� D. �ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com