
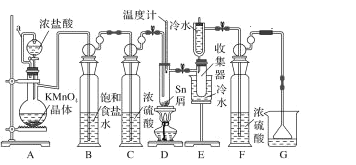
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点 232 ℃)与 Cl2反应制备 SnCl4,装置如图。
已知:①SnCl2、SnCl4 有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4 极易水解生成 SnO2·xH2O。回答下列问题:
(1)导管 a 的作用是_____,装置 A 中发生反应的离子方程式为_____。
(2)当观察到装置 F 液面上方_____时才开始点燃 D 处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________;②_____。
(3)若上述装置中缺少装置 C( 其它均相同) ,则D处具支试管中发生的主要副反应化学方程式为_____。
(4)Cl2和锡的反应产物有 SnCl4 和 SnCl2,为防止产品中带入过多的 SnCl2,可使用的温度范围是_____。
(5)滴定分析产品中 Sn(Ⅱ)的含量:用分析天平称取 5.000g 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用 0.1000 mol·L-1 的碘标准溶液滴定至终点时消耗 20.00 mL,则产品中 Sn(Ⅱ)的含量为_____。(已知 Sn2++I2=2I-+Sn4+)
【答案】平衡压强,使分液漏斗内液体顺利流下 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 出现黄绿色气体 加快氯气与锡的反应速率 使 SnCl4 汽化,利于其从混合物中分离出来 SnCl4+(x+2)H2O=SnO2·xH2O+4HCl 在 232 ℃到 652 ℃之间 4.76%
【解析】
由装置图可知,装置A应为制备氯气装置,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,B中饱和食盐水可以除去HCl,降低氯气的溶解,C中浓硫酸可以吸收水蒸气,干燥氯气;氯气与Sn在装置D中反应生成SnCl4,生成的SnCl4经冷却后在装置E中冷凝收集,未反应的氯气,用装置G吸收,为了防止尾气处理装置中水分进入装置E,在E和G之间用F装置干燥,以此分析解答。
(1)生成的氯气通过a进入浓盐酸上方,导致浓盐酸上方压强增大,从而使浓盐酸可以顺利进入烧瓶中,所以导管a的作用是使分液漏斗内的液体顺利流下;装置A中发生高锰酸钾和浓盐酸反应生成氯化锰、氯气和水,反应的离子方程式为2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O,故答案为:平衡压强,使分液漏斗内的液体顺利流下;2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O;
(2)为了排除装置中的空气,当观察到装置F液面上方出现黄绿色气体时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,为了加快氯气与锡反应的速率,同时使SnCl4气化,利于其从混合物中分离出来,需要继续加热,故答案为:出现黄绿色气体;加快氯气与锡反应的速率,使SnCl4气化;利于其从混合物中分离出来;
(3)若上述装置中缺少装置C(其它均相同),D装置中含有水蒸气,SnC14易水解,则D处具支试管中发生的主要副反应化学方程式为SnC14+(x+2)H2O=SnO2xH2O+4HCl,故答案为:SnC14+(x+2)H2O=SnO2xH2O+4HCl;
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,根据表中给出的信息分析,为了保证Sn熔融,及确保两种化合物的分离,四氯化锡收集在E中,不让二氯化锡进入E中,二氯化锡不形成蒸气即可,可采取的措施是:①控制Sn与氯气的反应温度在232℃至652℃之间,②通入过量氯气,故答案为:在232℃至652℃之间;
(5)滴定反应中+2价Sn被碘氧化成+4价Sn,碘被还原成碘离子,根据Sn2++I2=2I-+Sn4+得:n(I2)=n(Sn2+),则产品中Sn(II)的质量为:119g/mol×0.1000molL-1×0.02L=0.238g,产品中Sn(II)的含量为![]() ×100%=4.76%,故答案为:4.76%。
×100%=4.76%,故答案为:4.76%。


科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与
与![]() 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
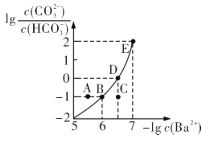
A.该溶液中![]()
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
(1)从0~2s该反应的平均速率v(NO2)=__。
(2)T1温度时化学平衡常数K=__L·mol-1。
(3)化学平衡常数K与速率常数k正、k逆的数学关系是K=__。若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.5mol·L-1的氨水和KOH溶液分别滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是
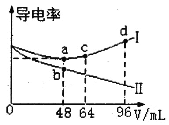
A.c1=0.2
B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段发生的反应为:A1(OH)3+OH-==[Al(OH)4]-
D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应![]() 设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

A.![]() 盐桥中的
盐桥中的![]() 移向
移向![]() 溶液
溶液
B.![]() 作负极,发生还原反应
作负极,发生还原反应
C.若将盐桥换成银丝,工作一段时间后,![]() 溶液中
溶液中![]() 减小
减小
D.若将盐桥换成银丝,当锌电极质量减少![]() ,银电极质量增加
,银电极质量增加![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个________,还有一种状态叫做________。
(2)写出![]() 原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与
原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与![]() 同周期的所有副族元素的基态原子中,最外层电子数与
同周期的所有副族元素的基态原子中,最外层电子数与![]() 相同的元素有_________种。
相同的元素有_________种。
(3)下列![]() 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
A 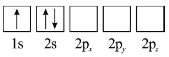 B
B 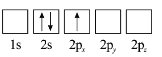
C 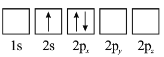 D
D 
Ⅱ.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层![]() 能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成
能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成![]() 型化合物,并知在
型化合物,并知在![]() 中,
中,![]() 与
与![]() 的质量比为
的质量比为![]() 原子的价电子排布式为
原子的价电子排布式为![]() 。根据以上条件,回答下列问题:
。根据以上条件,回答下列问题:
(1)C的基态原子的电子占据最高能层的符号为_______,![]() 原子的价电子排布图________。
原子的价电子排布图________。
(2)A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示)。
(3)元素B和D的电负性由大到小的顺序_________(用元素符号表示)。
(4)写出E的元素符号_________,要证明太阳光中含有E元素,可采用的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解得到某烃A,其球棍模型为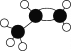 ,它是重要的化工基本原料。
,它是重要的化工基本原料。
①A的结构简式为_______。
②A与溴的四氯化碳溶液反应的化学方程式为_____________________。
③A能使酸性高锰酸钾溶液褪色,发生的反应类型为:______________。
④A的同系物B的相对分子质量比A大14,B的结构有________种。(不考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
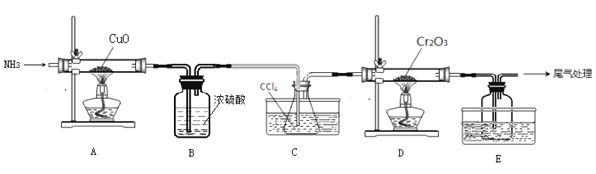
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com