
【题目】石油裂解得到某烃A,其球棍模型为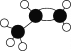 ,它是重要的化工基本原料。
,它是重要的化工基本原料。
①A的结构简式为_______。
②A与溴的四氯化碳溶液反应的化学方程式为_____________________。
③A能使酸性高锰酸钾溶液褪色,发生的反应类型为:______________。
④A的同系物B的相对分子质量比A大14,B的结构有________种。(不考虑顺反异构)。
【答案】CH3CH=CH2 CH3CH=CH2+Br2![]() CH3CHBrCH2Br 氧化反应 3
CH3CHBrCH2Br 氧化反应 3
【解析】
①根据A的模型得到A的结构简式为CH3CH=CH2;故答案为:CH3CH=CH2。
②A与溴的四氯化碳溶液发生加成反应,其反应的化学方程式为CH3CH=CH2+Br2![]() CH3CHBrCH2Br;故答案为:CH3CH=CH2+Br2
CH3CHBrCH2Br;故答案为:CH3CH=CH2+Br2![]() CH3CHBrCH2Br。
CH3CHBrCH2Br。
③A含有碳碳双键,被酸性高锰酸钾溶液氧化,发生的反应类型为氧化反应;故答案为:氧化反应。
④A的同系物B的相对分子质量比A大14,B的分子式为C4H8,四个碳的碳架结构有两种即C—C—C—C,![]() ,第一种碳架结构有两种同分异构,第二种碳架结构有一种同分异构,共3种;故答案为:3。
,第一种碳架结构有两种同分异构,第二种碳架结构有一种同分异构,共3种;故答案为:3。


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是__。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为__。阳离子[H2F]+的空间构型为__,写出[H2F]+的等电子体__(分子和离子各举一例)。
(3)SF6被广泛用于高压电器设备的绝缘介质。根据__理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图(图甲)计算键能,则S-F的键能为___kJmol-1。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20gmol-1的数据,原因是__。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__(填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为__(用元素符号表示)。
④工业上不用电解熔点更低的AlCl3制取铝的原因为__。
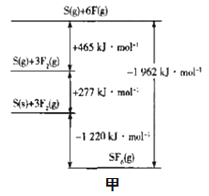
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__(填具体的微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
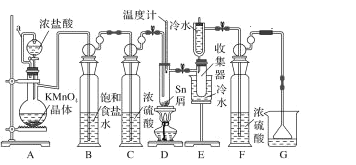
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点 232 ℃)与 Cl2反应制备 SnCl4,装置如图。
已知:①SnCl2、SnCl4 有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4 极易水解生成 SnO2·xH2O。回答下列问题:
(1)导管 a 的作用是_____,装置 A 中发生反应的离子方程式为_____。
(2)当观察到装置 F 液面上方_____时才开始点燃 D 处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________;②_____。
(3)若上述装置中缺少装置 C( 其它均相同) ,则D处具支试管中发生的主要副反应化学方程式为_____。
(4)Cl2和锡的反应产物有 SnCl4 和 SnCl2,为防止产品中带入过多的 SnCl2,可使用的温度范围是_____。
(5)滴定分析产品中 Sn(Ⅱ)的含量:用分析天平称取 5.000g 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用 0.1000 mol·L-1 的碘标准溶液滴定至终点时消耗 20.00 mL,则产品中 Sn(Ⅱ)的含量为_____。(已知 Sn2++I2=2I-+Sn4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
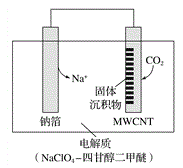
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废气中的SO2经如图中的两个循环可分别得到S和H2SO4。下列说法正确的是
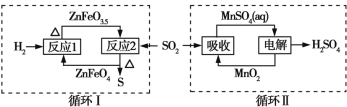
A. 循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
B. 循环Ⅰ中,反应2中的还原产物为ZnFeO4
C. Mn可作为循环Ⅱ中电解过程中的阳极材料
D. 循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用__个原子轨道;雌黄分子式为As2S3,分子结构如图,则砷原子的杂化方式为__。

(2)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是__(填元素符号),SO42-的空间构型为__,晶体中含有的化学键有__。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是__。
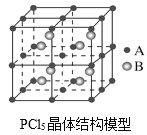
(3)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的空间构型和相似的化学键特征,则A为__,B为__。
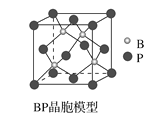
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为xcm,磷化硼的摩尔质量为bg·mol-1,阿伏加德罗常数为NA,则磷化硼晶体密度的表达式为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
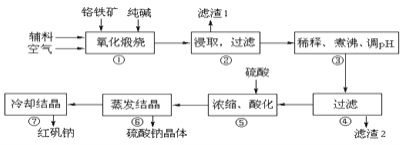
①中涉及的主要反应有:
主反应:![]()
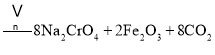
副反应: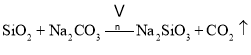 、
、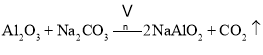
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素-3-羧酸![]() 是一种重要的香料,常用作日常用品或食品的加香剂。
是一种重要的香料,常用作日常用品或食品的加香剂。
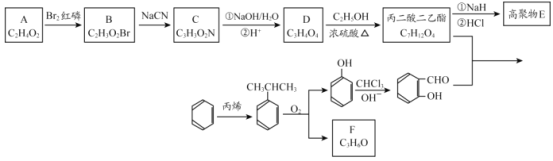
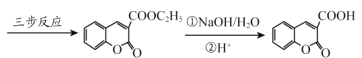
已知:
RCOOR′+ R″OH ![]() RCOOR″ + R′OH(R 代表烃基)
RCOOR″ + R′OH(R 代表烃基)
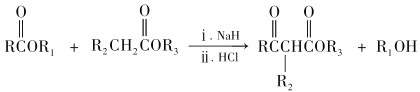
(1)A和B均有酸性,A 的结构简式__________;苯与丙烯反应的类型是_______。
(2)F 为链状结构,且一氯代物只有一种,则F 含有的官能团名称为__________。
(3)D→丙二酸二乙酯的化学方程式:_______。
(4)丙二酸二乙酯在一定条件下可形成聚合物 E,其结构简式为:________。
(5)写出符合下列条件的丙二酸二乙酯同分异构体的结构简式:________。
①与丙二酸二乙酯的官能团相同;
②核磁共振氢谱有三个吸收峰,且峰面积之比为 3:2:1;
③能发生银镜反应。
(6)丙二酸二乙酯与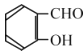 经过三步反应合成
经过三步反应合成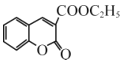 。
。
请写出中间产物的结构简式。
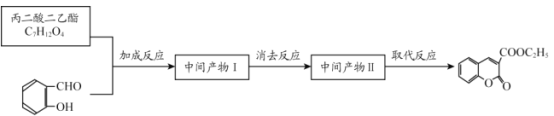
中间产物I__________;中间产物II___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数。 下列说法正确的是
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.对于反应:3A(g)+2B(g) 4C(s)+2D(g)的化学平衡常数表达式为 K= ![]()
C.KW 不是水的电离平衡常数
D.难溶电解质 AB2 饱和溶液中,c(A2+)=x mol·L-1,c(B-)=y mol·L-1,则 Ksp 值为 4xy2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com