
����Ŀ�������仯������;ʮ�ֹ㷺���ش��������⣺
��1��������OF2��NF3��SiF4��PF5��SF6�У�����ԭ�Ӳ�ȡsp3�ӻ�����__��
��2��[H2F]+[SbF6]-(������)��һ�ֳ�ǿ�ᡣ��ļ۵����Ų�ʽΪ__��������[H2F]+�Ŀռ乹��Ϊ__��д��[H2F]+�ĵȵ�����__�����Ӻ����Ӹ���һ������
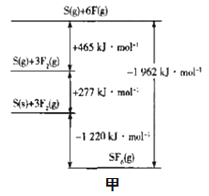
��3��SF6���㷺���ڸ�ѹ�����豸�ľ�Ե���ʡ�����__���ۣ����жϳ���ռ乹��Ϊ�������塣SF6�ļ��ܿ�ͨ������Born-Haberѭ��������������ͼ��ͼ�ף�������ܣ���S-F�ļ���Ϊ___kJmol-1��
��4����ҵ�ϵ��Al2O3��ȡ�������������ñ���ʯNa3[AlF6]����Al2O3���۵㡣����ʯ������ԭ��Ϊ2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2��+9H2O��
�ٲⶨ��̬HF��Ħ������ʱ�������ò���20gmol-1�����ݣ�ԭ����__��
�ڱ���ʯ�ľ��岻���磬������ʱ�ܵ��磬���ڱ���ʯ�����д���__(�����)��
a.���Ӽ� b.���Լ� c.��λ�� d.���»���
�۷�Ӧ����Ԫ�أ�����⣩�ĵ�һ�����ܴӴ�С��˳��Ϊ__(��Ԫ�ط��ű�ʾ)��
�ܹ�ҵ�ϲ��õ���۵���͵�AlCl3��ȡ����ԭ��Ϊ__��
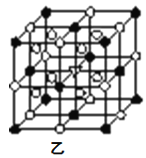
�ݱ���ʯ�����������ɣ�����ʯ�ľ����ṹ��ͼ����ʾ����λ�ڴ�������Ķ�������ģ���λ�ڴ��������12������е��8��С����������ģ���ô������������Ĵ�������������__(������������)��
���𰸡�OF2��NF3��SiF4 5s25p3 V�� H2O��H2S��NH2- �۲���ӻ��� 327 ������̬HF���Ӽ����������� abc F��O��C��Al��Na AlCl3Ϊ���Ӿ��壬���ڲ����磬����� Na+
��������
(1)OF2��O�γ�2���������µ��Ӷ�=![]() =2���ܹ����Ӷ���Ϊ2+2=4������OF2Ϊsp3�ӻ����ʷ������⣻NF3��N�γ�3���������µ��Ӷ�=
=2���ܹ����Ӷ���Ϊ2+2=4������OF2Ϊsp3�ӻ����ʷ������⣻NF3��N�γ�3���������µ��Ӷ�=![]() =1���ܹ����Ӷ���Ϊ1+3=4������Ϊsp3�ӻ����ʷ������⣻ SiF4��Si�γ�4��������û�йµ��Ӷԣ��ܹ����Ӷ���Ϊ0+4=4������Ϊsp3�ӻ����ʷ������⣻PF5��P�γ�5��������û�йµ��Ӷԣ��ܹ����Ӷ���Ϊ0+5=5������Ϊsp3d�ӻ����ʲ��������⣻SF6��S�γ�6���������µ��Ӷ�=
=1���ܹ����Ӷ���Ϊ1+3=4������Ϊsp3�ӻ����ʷ������⣻ SiF4��Si�γ�4��������û�йµ��Ӷԣ��ܹ����Ӷ���Ϊ0+4=4������Ϊsp3�ӻ����ʷ������⣻PF5��P�γ�5��������û�йµ��Ӷԣ��ܹ����Ӷ���Ϊ0+5=5������Ϊsp3d�ӻ����ʲ��������⣻SF6��S�γ�6���������µ��Ӷ�=![]() =0���ܹ����Ӷ���Ϊ0+6=6Ϊsp3d2�ӻ����ʲ��������⣻�ʴ�Ϊ��OF2��NF3��SiF4��
=0���ܹ����Ӷ���Ϊ0+6=6Ϊsp3d2�ӻ����ʲ��������⣻�ʴ�Ϊ��OF2��NF3��SiF4��
(2)��Ϊ�������ڵ�V����Ԫ�أ���۵����Ų�ʽΪ5s25p3��[H2F]+��H2O��NH2-��Ϊ�ȵ����壬�ṹ���ƣ���ռ乹�;�Ϊ��V�ͣ��ʴ𰸣�5s25p3��V�ͣ�H2O��NH2-��
(3)SF6���㷺���ڸ�ѹ�����豸�ľ�Ե���ʡ����ݼ۲���ӻ������ۣ����жϳ���ռ乹��Ϊ�������塣����Born-Haberѭ��������������ͼ��֪��S(s)+3F2(g)![]() SF6��S-F�ļ���=
SF6��S-F�ļ���=![]() =327kJ��mol-1���ʴ�Ϊ���۲���ӻ��⣻327��
=327kJ��mol-1���ʴ�Ϊ���۲���ӻ��⣻327��
(4)����ΪHF���Ӽ��������������ڲⶨ��̬HF��Ħ������ʱ���в���HF����ͨ�����������ˣ������ò���20gmol-1�����ݣ��ʴ𰸣��в���HF����ͨ�����������ˣ�
�ڱ���ʯ(Na3AlF6)���岻���磬������ʱ�ܵ��磬˵���������ӻ�����������Ӽ�����Na+��[AlF6]3-���ɣ�[AlF6]3-�к�����λ����Ҳ���ڼ��Լ�����ѡ��abc��
�۱���ʯ������ԭ��Ϊ2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2��+9H2O����Ӧ����Ԫ��(�����)����Al��O��F��Na��CԪ�أ����ݷǽ�����Խǿ����縺��Խǿ��������Խ���������ǵĵ�һ�����ܴӴ�С��˳��ΪF��O��C��Al��Na��
����ΪAlCl3Ϊ������������ڷ��Ӿ��壬������״̬�£����ܵ����Al3+�����Թ�ҵ�ϲ��õ���۵���͵�AlCl3��ȡ�����ʴ𰸣���ΪAlCl3���ڷ��Ӿ��壬������״̬�£����ܵ����Al3+��
�ݡ�ĸ���=8![]() +6
+6![]() =4�������=12
=4�������=12![]() +8=11��Ҫʹ�������ӵĸ���֮��Ϊ1:3���������������Ĵ�������������Na+���ʴ�Ϊ��Na+��
+8=11��Ҫʹ�������ӵĸ���֮��Ϊ1:3���������������Ĵ�������������Na+���ʴ�Ϊ��Na+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ᣨH3PO3��Ϊ��Ԫ���ᣬ25��ʱ����Na2HPO3��Һ�е������ᣬ�����Һ�е��й�����Ũ��֮�ȵĶ�������ҺpH�Ĺ�ϵ��ͼ��ʾ������������ȷ����

A.M��W�������ڵ�ֱ�߱�ʾpH��![]() �ı仯��ϵ
�ı仯��ϵ
B.����Һ������ʱ�����ܴ��ڣ�c��Na������c��![]() ����2c��
����2c��![]() ��
��
C.ͼ��N���ʾ�����HCl�����ʵ�����ԭ��Һ��Na2HPO3���ʵ������
D.25��ʱ��![]() ��H2O
��H2O![]()
![]() ��OH����ƽ�ⳣ��Ϊ1��0��10��12.57
��OH����ƽ�ⳣ��Ϊ1��0��10��12.57
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��B��C��D��E����Ԫ�أ�ԭ��������������A�Ƕ�������ԭ�Ӱ뾶����Ԫ�أ�BԪ��3p�ܼ��������C���������ڵ縺������Ԫ�أ�D�ǵ�������δ�ɶԵ�������Ԫ�أ�E��ԭ��������D��3���Իش������йص����⣺
��1��д��DԪ�ؼ۵��ӵĵ����Ų�ͼ��______________��
��2��D���γɻ�����[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3�������ӵ����幹����____________��NO2������ԭ�ӵĹ���ӻ�����Ϊ______________��1 mol [D(H2O)6] 3+ �к��еĦҼ���Ϊ ______________��
��3����֪B��C����Ԫ���γɵĻ�����ͨ�������֡������ֻ�������___________ ���ѧʽ��Ϊ�Ǽ��Է��ӡ���һ�����ʵĵ���ʽΪ ______________��
��4��D��һ��Ӳ�����ʴ��ǿ�Ľ����������ڵ�ƺ��������ָ֡���ͼΪD�ľ����ṹͼ����D��������___________�ѻ����þ�����ԭ�ӵ����ռ��������İٷ���Ϊ___________������֪����=3.14��![]() =1.732��
=1.732��

��5��E�����һ�־���(��ͼ��ʾ)�ı߳�Ϊanm���ܶ�Ϊ��g��cm��3��NA��ʾ�����ӵ�������ֵ����E��ԭ�Ӱ뾶Ϊ___________nm��E�����ԭ�������ɱ�ʾΪ___________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ѧϰ��ͬѧ�ǶԺ�۱�ʶ����̽�����仯������ƽ��˼���ѧ���������˽�һ������ʶ�����⡣�������ѧ֪ʶ�ش��������⣺
��1��Ǧ�����ǵ��͵Ŀɳ���͵�أ�����ܷ�ӦʽΪ��Pb��PbO2��4H����2SO42-![]() 2PbSO4 ��2H2O���ŵ�ʱ�������ĵ缫��Ӧʽ��_______�����ʱ�������·ͨ�� 0.2 mol ����ʱ�����������������������_________g��
2PbSO4 ��2H2O���ŵ�ʱ�������ĵ缫��Ӧʽ��_______�����ʱ�������·ͨ�� 0.2 mol ����ʱ�����������������������_________g��
��2����֪�������£�Ksp[Mg��OH��2]��1.8��10-11��Ksp[Fe��OH��3]��4��10-38��
�ٳ����£�ij���� MgCl2 ��Һ�к��������� FeCl3 ��Ϊ�˵õ������� MgCl2��2H2O ���壬Ӧ����_________�ѧʽ����������Һ�� pH��4��ʹ��Һ�е� Fe3+ת��Ϊ Fe��OH��3��������ʱ��Һ�е� c��Fe3+����_________mol��L-1��
�ڳ����£����� 0.01 mol��L-1 MgCl2 ��Һ������________mol��L-1 NaOH ��Һ��������ʱ�г������ɡ�
��3��25��ʱ���������ӿ�ʼ����ʱ�� pH ���±���
���� | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
������ͬŨ�� Cu2+��Mg2+��Fe2+����Һ�еμ� NaOH ��Һʱ��__________�ȳ����������ӷ��ţ���Ҫʹ 0.3mol��L-1 ����ͭ��Һ��Cu2+������Ϊ��ȫ���� Cu2+Ũ�Ƚ��� 10-5 mol��L-1ʱ������Ӧ����Һ���������������Һʹ��Һ pH Ϊ________��KspCu��OH��2=1��10-20��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ѫ��[�����軯�أ�K4Fe(CN)6]Ŀǰ�㷺����ʳƷ���Ӽ�(�����)���ҹ��������涨ʵ���л�Ѫ�ε����ʹ����Ϊ10mg/kg��һ���Ʊ���Ѫ�εĹ�����ͼ��

�ش��������⣺
��1��������Ʊ���Ca2Fe(CN)6������ˮ��__(����ܡ������ܡ�)��
��2�������Ļ�ѧ����ʽΪ__��
��3����������õ��Լ�X��__(�ѧʽ)��
��4���������õ��綾��HCN��Һ����CN-�ķ�ˮ���봦��������ŷš�
��֪��HCN��һ�־��п�����ζ����ɫ�綾Һ�壬�ӷ���25��ʱKa(HCN)=6.25��10-10����Һ��H2CO3��HCO3-��CO32-�Ĵ�������ҺpH�Ĺ�ϵ��ͼ��ʾ��

��HCN�ĵ���ʽΪ__��
�ڴ�����CN-��ˮ�ķ�������һ������pH��10����NaClO��Һ�Ƚ�CN-����ȫ����ΪOCN-���ڶ�������pHΪ7.5��8.5����NaClO��Һ��ȫ����OCN-����N2�������Ρ���һ������ǿ���Ե���ҪĿ����__���ڶ�����Ӧ�����ӷ���ʽΪ__��
��5����֪��ɫȾ����³ʿ���ĺϳɷ�����ͼ��

����������������ֽ���Լ���ʳƷ���Ƿ���CN-��������ͼ��
![]()
����ֽ������֤��ʳƷ�к���CN-��������³ʿ���ĺϳ�ԭ�����������ӷ���ʽ���ͼ��ʱ��ֽ������ԭ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.20 mol/LKMnO4������Һ 0.l0L��һ����pH=3.0�IJ���(HOOC-COOH)��Һ��ϣ��ų�VL���塣NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.9 g HOOC-COOH�����õ��Ӷ���ĿΪ0.9NA
B.��0.01mol KMnO4 ����ԭʱ��ǿ���ṩ��H+��ĿΪ 0.01NA
C.pH=3.0�IJ�����Һ����H+��ĿΪ0.001NA
D.�÷�Ӧ�ͷ� CO2������ĿΪVNA/22.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijNa2CO3��NaHCO3�Ļ����Һ�м���������BaCl2�������Һ��![]() ��
��![]() �Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
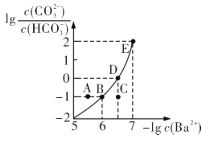
A.����Һ��![]()
B.B��D��E�����Ӧ��ҺpH�Ĵ�С˳��ΪB>D>E
C.A��B��C�����Ӧ�ķ�ɢϵ�У�A����ȶ������
D.D���Ӧ����Һ��һ������2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T1�¶�ʱ���ݻ�Ϊ2L�ĺ����ܱ�������ֻ����1.00molNO2���巢����Ӧ��2NO(g)+O2(g)![]() 2NO2(g) H<0��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)���±���
2NO2(g) H<0��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
��1����0��2s�÷�Ӧ��ƽ������v(NO2)=__��
��2��T1�¶�ʱ��ѧƽ�ⳣ��K=__L��mol-1��
��3����ѧƽ�ⳣ��K�����ʳ���k����k������ѧ��ϵ��K=__�������������¶ȸı�ΪT2ʱ��k��=k������T2__T1(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ���ѽ�õ�ij��A,�����ģ��Ϊ ,������Ҫ�Ļ�������ԭ�ϡ�
,������Ҫ�Ļ�������ԭ�ϡ�
��A�Ľṹ��ʽΪ_______��
��A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ_____________________��
��A��ʹ���Ը��������Һ��ɫ�������ķ�Ӧ����Ϊ��______________��
��A��ͬϵ��B����Է���������A��14,B�Ľṹ��________�֡���������˳���칹����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com