
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
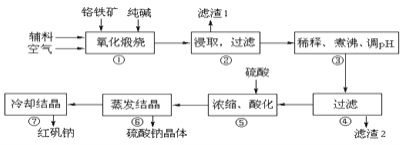
①中涉及的主要反应有:
主反应:![]()
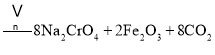
副反应: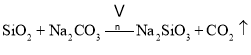 、
、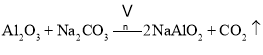
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
【答案】使反应物接触更充分,加快反应速率 除去溶液中的![]() 、
、![]()
![]()
![]()
![]() 当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色 ![]()
【解析】
铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧、主反应:![]() ,副反应:
,副反应:![]() 、
、![]() ,水浸之后除去生成的氧化铁,调节pH至4.7,除去溶液中的AlO2、SiO32,经酸化、蒸发结晶后后可生成重铬酸钠;
,水浸之后除去生成的氧化铁,调节pH至4.7,除去溶液中的AlO2、SiO32,经酸化、蒸发结晶后后可生成重铬酸钠;
(1)固体反应物在搅拌时可充分接触而反应;
(2)氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁,副反应中生成Na2SiO3、NaAlO2等杂质;
(3)CrO42转化为Cr2O72,CrO42在酸性条件下与H+离子反应生成Cr2O72;
(4)①溶液中有碘,加入淀粉溶液呈蓝色;
②根据反应的关系式计算。
(1)固体反应物在搅拌时可充分接触而反应,故答案为:使反应物接触更充分,加快反应速率;
(2)氧化铁不溶于水,铬铁矿经煅烧、水浸之后除去生成的氧化铁,副反应中生成![]() 、
、![]() 等杂质,调节pH至
等杂质,调节pH至![]() ,可生成
,可生成![]() 、
、![]() 沉淀过滤除去,故答案为:除去溶液中的
沉淀过滤除去,故答案为:除去溶液中的![]() 、
、![]() ;(3)
;(3)![]() 转化为
转化为![]() ,
,![]() 在酸性条件下与
在酸性条件下与![]() 离子反应生成
离子反应生成![]() ,该反应为可逆反应,反应的离子方程式为
,该反应为可逆反应,反应的离子方程式为![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
(4)①溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②根据反应的关系式计算:

![]() ,则
,则![]() 重铬酸钠试样中含有的重铬酸钠晶体的质量为
重铬酸钠试样中含有的重铬酸钠晶体的质量为![]() ,
,
所得产品的中重铬酸钠晶体的纯度![]() ,
,
故答案为:![]() .
.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.2 mol/(L·min)
B.B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.根据对角线规则,推出铍的氢氧化物能与氢氧化钠溶液反应
B.根据同周期元素的电负性变化趋势,推出Mg的电负性比Al大
C.SiO44-和SO42-的空间构型相同
D.碳原子在某种情况下的最外层电子排布图可能为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取8.54 g含有Na2CO3、NaOH、Ba(NO3)2的固体混合物溶于足量水中,向反应后的试管中逐滴滴加1.00 mol·L-1的盐酸,加入盐酸的体积和沉淀质量的关系如图所示。

(1)混合物中Ba(NO3)2的物质的量至少为________mol。
(2)X的最大值为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的二种酸HX、
的二种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如下表,下列判断正确的是
,实验数据如下表,下列判断正确的是![]()
数据编号 | NaOH加入的体积 | 溶液的pH | |
|
| ||
① | 0 | 3 | 1 |
② | a | 7 | |
③ |
| x | y |
A.在相同温度下,同浓度的两种酸溶液的导电能力顺序![]()
B.由表中数据可估算出![]()
C.HY和HX混合,![]()
D.上述②反应后的HY溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
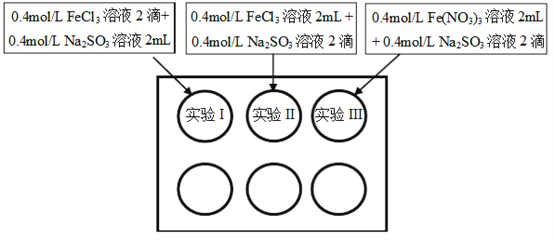
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g·cm-3)配制1mol·L-1的稀硫酸100 mL,现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按实验时使用仪器的先后顺序,排列正确的是 ( )
A.②⑥③⑦⑤⑥B.②③⑦⑤⑥C.①③⑤⑦④⑥D.④⑦③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg ![]() 的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( )

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a<b
C.相同温度下,电离常数K(HX):a>b
D.lg ![]() =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com