
【题目】某温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.2 mol/(L·min)
B.B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)NaHA溶液的pH___(填大于、小于或等于)Na2A溶液的pH。
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是___。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有___。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有___。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子, F的最高化合价和最低化合价的代数和为4。R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2∶1。G位于周期表第6纵行且是六种元素中原子序数最大的。请回答下列问题:
(1)D元素的电负性_______F元素的电负性(填“>”、“<”或“=”)。
(2)G的价电子排布图_________________________________。
(3)B形成的晶体堆积方式为________,区分晶体和非晶体最可靠的科学方法是对固体进行_______实验。
(4)D-的最外层共有______种不同运动状态的电子,有___种能量不同的电子。F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是___________,F2D2是______分子(填“极性”或“非极性”)。
(5)A与E形成的最简单化合物分子空间构型为_____,在水中溶解度很大。该分子是极性分子的原因是_____。
(6)R的晶胞如图所示,设F2-半径为r1 cm,B+半径为r2cm。试计算R晶体的密度为______。(阿伏加德罗常数用NA表示,写表达式,不化简)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
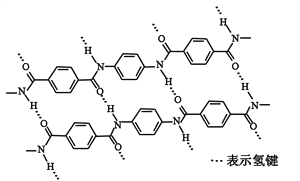
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②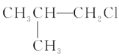 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰及化合物广泛应用于工业生产、制造业等领域。
(1)科研人员将锰粉碎后加入到![]() 溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应
溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应![]() (已知含
(已知含![]() 水溶液为米黄色)
水溶液为米黄色)
①为加快上述反应速率可以采取的措施有________(写出一条即可)。不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
②下列说明反应已达平衡的有_______(填编号)。
A.溶液的颜色不发生变化
B.溶液中![]()
C.体系中固体的质量不变
D.![]() 与
与![]() 浓度的比值保持不变
浓度的比值保持不变
③室温下,测得溶液中阳离子浓度![]() 随时间的变化情况如下图所示,则上述反应的平衡常数K=___,
随时间的变化情况如下图所示,则上述反应的平衡常数K=___,![]() 的转化率为_____。
的转化率为_____。

④若其他条件不变,10mim后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时![]() =_____(不考虑离子水解的影响)。
=_____(不考虑离子水解的影响)。
(2)![]() 也可在
也可在![]() 为体系的电解液中电解获得,其阳极反应式为_____。
为体系的电解液中电解获得,其阳极反应式为_____。
(3)电解制锰后的废水中含有![]() ,常用石灰乳进行一级沉降得到
,常用石灰乳进行一级沉降得到![]() 沉淀,过滤后再向滤液中加入等体积的
沉淀,过滤后再向滤液中加入等体积的![]() 溶液,进行二级沉降,为了将
溶液,进行二级沉降,为了将![]() 的浓度降到
的浓度降到![]() ,则加入的
,则加入的![]() 溶液的浓度至少是___mol/L[已知
溶液的浓度至少是___mol/L[已知![]() ]。
]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. X极是电源负极,Y极是电源正极
B. 电解过程中CuSO4溶液的pH逐渐增大
C. a极的电极反应是2Cl--2e-=Cl2↑
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
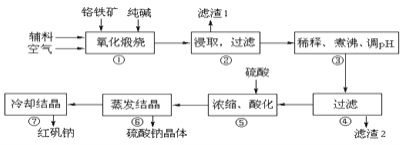
①中涉及的主要反应有:
主反应:![]()
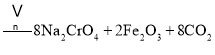
副反应: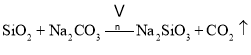 、
、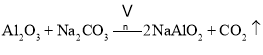
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=_______、T1=______/span>;通过实验______(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_____。
(3)忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=____mol·L-1·min-1。
(二)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2):
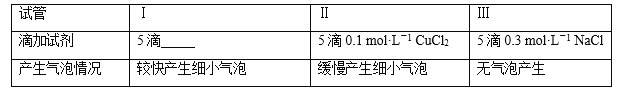
(1)上表试管Ⅰ中应添加的试剂为5滴____________。
(2)结论是_________,实验Ⅲ的目的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com