
【题目】阿巴卡韦(Abacavir) 是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(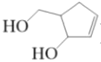 ),下列说法正确的是
),下列说法正确的是
A.与环戊醇互为同系物B.分子中所有碳原子共平面
C.和1 mol 钠反应可以生成 22.4 L 氢气D.可用碳酸氢钠溶液鉴别乙酸和M
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为____。
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体
实验方案:请仿照教材设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各种化学键如图所示。下列有关反应断键位置说明错误的是( )
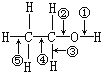
A.乙醇和浓硫酸,共热到170℃时断键②⑤
B.乙醇和浓硫酸,共热到140℃时断键①④
C.乙醇和金属钠的反应断键①
D.乙醇在Cu催化下与O2反应时断键①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__。
实验二:测定Na2CS3溶液的浓度
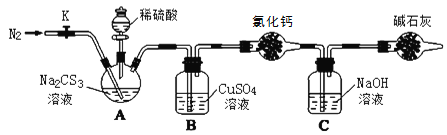
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL-1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放碱石灰的仪器的名称是__,碱石灰的主要成分是__(填化学式)。
(4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是_。
(5)C中发生反应的离子方程式是__。
(6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为__。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
2NH3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙红色)+H2O。下列说法正确的是
Cr2O72-(橙红色)+H2O。下列说法正确的是
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
D. 增大CrO42-浓度,平衡向右移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在煤的化工生产中,我们常常需要研究不同温度下的平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表,
H2(g)+CO2(g)的平衡常数随温度的变化如下表,
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数/K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_________(填“增大”、“减小”或“不变”),容器内混合气体的压强___________(填“增大”、“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有_______________(选填字母)。
投料 | A | B | C | D |
n(CO2)/mol | 3 | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2 | 5 | 2 | 3 | 2 |
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g),2min达到平衡时,CO的转化率为____________,用CO2表示的平均反应速率V(CO2)为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com