
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__。
实验二:测定Na2CS3溶液的浓度
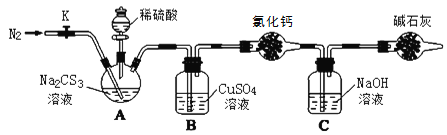
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL-1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放碱石灰的仪器的名称是__,碱石灰的主要成分是__(填化学式)。
(4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是_。
(5)C中发生反应的离子方程式是__。
(6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为__。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值__(填“偏高”、“偏低”或“无影响”)。
【答案】CS32-+H2O![]() HCS3-+OH- S 干燥管 CaO和 NaOH 将装置中残留的CS2和H2S全部排入后续装置中,使其被完全吸收 CS2+2OH-=COS22-+H2O 1.75mol/L 偏高
HCS3-+OH- S 干燥管 CaO和 NaOH 将装置中残留的CS2和H2S全部排入后续装置中,使其被完全吸收 CS2+2OH-=COS22-+H2O 1.75mol/L 偏高
【解析】
(1)依据三硫代碳酸钠(Na2CS3)与碳酸钠性质相近,书写水解反应方程式;
(2)根据由Na2CS3化学式中各元素化合价判断被氧化的元素;
(3)根据碱石灰的组成选择装置;
(4)根据CS2和H2S均有毒,CS2不溶于水。装置中有CS2和H2S残留回答;
(5)根据CS2不溶于水,和CO2某些性质相似解答;
(6)根据物料守恒和原子守恒、电子守恒进行计算;
(7)根据空气的成分进行回答。
(1)碳酸钠溶液因碳酸根离子水解而显碱性,因为三硫代碳酸钠(Na2CS3)与碳酸钠性质相近,所以Na2CS3溶液中CS32-也会发生水解显碱性,其反应的离子方程式为CS32-+H2O![]() HCS3-+OH-,所以滴入酚酞试液后,溶液也会变红色。故答案:CS32-+H2O
HCS3-+OH-,所以滴入酚酞试液后,溶液也会变红色。故答案:CS32-+H2O![]() HCS3-+OH-;
HCS3-+OH-;
(2)由Na2CS3化学式可知:S为-2价具有还原性,碳为+4价具有氧化性,Na为+1价,所以向溶液中滴加酸性KMnO4溶液,紫色褪去说明发生了氧化还原反应,该反应中被氧化的元素是硫,故答案:S;
(3)由装置图可知,盛放碱石灰的仪器是干燥管,碱石灰的主要成分是氧化钙和氢氧化钠的混合物,故答案:干燥管;CaO和 NaOH;
(4)因为CS2和H2S均有毒,CS2不溶于水。装置中有CS2和H2S残留,所以反应结束后打开活塞K,再缓慢通入热N2将残留在装置中的CS2和H2S气体全部赶出到下一个装置被全部吸收,故答案:赶出残留在装置中的CS2和H2S气体到下一个装置被全部吸收;
(5)CS2不溶于水,和CO2某些性质相似,能与NaOH作用,生成Na2COS2和H2O ,所以C中发生反应的离子方程式是CS2+2OH-=COS22-+H2O,故答案:CS2+2OH-=COS22-+H2O;
(6)由Na2CS3+H2SO4=Na2SO4+CS2+H2S↑和H2S+Cu2+= 2H++CuS↓可知。Na2CS3~CuS,B中的固体8.4g是CuS的质量,所以物质的量为n(Na2CS3)=n(CuS)=![]() ,Na2CS3溶液的浓度c=
,Na2CS3溶液的浓度c= =1.75mol/L,故答案:1.75mol/L;
=1.75mol/L,故答案:1.75mol/L;
(7)因为C中溶液为氢氧化钠溶液,如果反应结束后将通热N2改为通热空气,空气中含有二氧化碳也会和氢氧化钠反应,在成C中的质量偏高,使测量的结果也偏高,故答案:偏高。


科目:高中化学 来源: 题型:
【题目】为测定某大理石样品中CaCO3的纯度,称取10.0g大理石样品投入到50mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成1.12L(标准状况)CO2气体。
计算:(1)该大理石样品中CaCO3的质量分数___。
(2)盐酸的物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 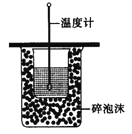
B. 比较Cu2+、Fe3+对反应速率的影响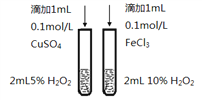
C. 比较醋酸和硼酸的酸性强弱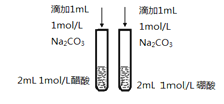
D. 比较温度对化学反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
(1)测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,反应的离子方程式为:
4MnO4-+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4-+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
(2)测定装置:部分装置如图所示(a、b为止水夹)

(3)实验步骤:
① 检查装置气密性(气密性良好)。
② 用___________(填仪器名称)准确移取20.00 mL 2.00×10-3mol·L—1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L-1的H2SO4溶液备用。
③ 将2.00×10-3mol·L-1的草酸标准溶液置于_____________(填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?___________。
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将_________(填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。本实验是否需要指示剂?_________(填“是或否”),滴定终点时的实验现象为____________________。
⑦ 再重复实验2次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 20.00mL):
装修后 第n天 | 草酸溶液(mL) | 甲醛的浓度 mg/m3 | |||
1 | 2 | 3 | 平均值 | ||
1 | 15.86 | 15.72 | 15.67 | 15.75 | |
7 | 26.17 | 26.36 | 26.38 | 26.27 | |
30 | 49.05 | 48.98 | 49.02 | 48.95 | |
设 KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为v1(mL),草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为v2(mL)则:计算室内空气中甲醛浓度(mg/m3)的代数式为__________(用c1、c2 、v1、v2表示),利用表中数据计算第30天室内空气中甲醛浓度为_______mg/m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:
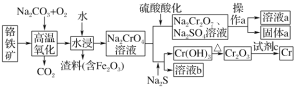
已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,不属于取代反应的是( )
A. ![]() +Cl2
+Cl2![]() +HCl
+HCl
B. CH2=CH2 + Br2 →CH2BrCH2Br
C. ClCH2CH2CH3+NaOH![]() HOCH2CH2CH3+NaCl
HOCH2CH2CH3+NaCl
D. ![]() +HO-NO2
+HO-NO2![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有()
![]()
①C、O2②Na、O2③Fe、HNO3④S、O2⑤N2、O2⑥H2S、O2⑦NH3、O2
A.四项B.五项C.六项D.七项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是__,该化合物是由__键形成。
(2)Na3N与盐酸反应生成__种盐,反应的化学方程式是__。
(3)比较Na3N中两种微粒的半径:r(Na+)___r(N3-)(填“>”、“=”、“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com