

| A. | 向该溶液中加入Mg有H2逸出 | |
| B. | 向该溶液中加入少量FeCl2,其离子反应方程式为:2NO3-+6I-+4H2O | |
| C. | 该溶液还可能大量存在MnO4-、ClO- | |
| D. | 向该溶液中逐滴加入Na2CO3溶液至过量,既有气体逸出又有沉淀生成 |
分析 A.金属和硝酸反应,无氢气生成;
B.硝酸具有强氧化性能氧化亚铁离子为铁离子;
C.NH4+、Al3+为弱碱的阳离子,ClO-为弱酸的酸根离子,阳离子和酸根离子易发生双水解;
D.向该溶液中逐滴加入Na2CO3溶液至过量,反应掉溶液中的氢离子生成二氧化碳,碳酸根离子和铝离子发生双水解生成氢氧化铝沉淀.
解答 解:A.根据图示可知溶液中存在H+、NH4+、Al3+、NO3-离子,H+和NO3-离子相当于稀硝酸,金属镁溶于很稀的硝酸溶液,生成硝酸镁、硝酸铵和水,镁和稀硝酸也可发生反应:3Mg+8HNO3=3Mg(NO3)2+2NO↑+4H2O,无H2逸出,故A错误;
B.硝酸根离子在酸性条件下,具有强氧化性,与亚铁离子发生氧化还原反应,可知发生的离子反应为4H++NO3-+3Fe2+=NO↑+3Fe3++4H2O,故B错误;
C.NH4+、Al3+为弱碱的阳离子,ClO-为弱酸的酸根离子,NH4+和ClO-、Al3+和ClO-都能发生双水解,故C错误;
D.向该溶液中逐滴加入Na2CO3溶液至过量,反应掉溶液中的氢离子生成二氧化碳,离子反应为CO32-+2H+=H2O+CO2↑,继续滴加入Na2CO3溶液,铝离子和碳酸根离子水解相互促进生成氢氧化铝沉淀和二氧化碳,故D正确;
故选D.
点评 本题考查离子反应,是高考中常考考点,明确发生的化学反应是解答本题的关键,侧重考查了溶液中的离子的双水解问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加成反应 | B. | 取代反应 | C. | 酯化反应 | D. | 水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| D. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
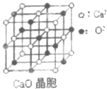 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离常数随着弱电解质浓度的增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$ | |
| C. | 电离常数只受温度影响,与浓度无关 | |
| D. | CH3COOH溶液中加入少量CH3COONa固体,电离常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向NaCl溶液中先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 | 说明Ksp(AgI)<Ksp(AgCl) |
| B | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 说明SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 说明氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com