
分析 X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素,据此解答.
解答 解:X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素.
(1)由上述分析可知,X为O元素,Y为Cl元素,M为H元素,故答案为:O;Cl;H;
(2)N单质与NaOH溶液反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,故答案为:Si+2OH-+H2O=SiO32-+2H2↑;
(3)S与Cl相比,非金属性较强的元素是Cl,可以证明该结论的实验是(用离子方程式表示):Cl2+S2-=2Cl-+S↓,故答案为:Cl;Cl2+S2-=2Cl-+S↓.
点评 本题考查结构性质位置关系综合应用,难度不大,注意元素金属性与非金属性强弱比较实验事实.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
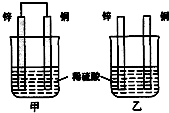 (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HClO4>H2SO4 | D. | 相对分子质量:Ar>K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向该溶液中加入Mg有H2逸出 | |
| B. | 向该溶液中加入少量FeCl2,其离子反应方程式为:2NO3-+6I-+4H2O | |
| C. | 该溶液还可能大量存在MnO4-、ClO- | |
| D. | 向该溶液中逐滴加入Na2CO3溶液至过量,既有气体逸出又有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com