
| A. | 电离常数随着弱电解质浓度的增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$ | |
| C. | 电离常数只受温度影响,与浓度无关 | |
| D. | CH3COOH溶液中加入少量CH3COONa固体,电离常数减小 |
分析 A.电离常数只随温度的变化而变化;
B.电离常数是离子浓度之积与分钟浓度的比值;
C.电离常数只随温度的变化而变化;
D.电离常数只随温度的变化而变化.
解答 解:A.电离常数只随温度的变化而变化,与弱电解质的浓度无关,故A错误;
B.电离常数是离子浓度之积与分钟浓度的比值,则CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,故B错误;
C.电离常数只随温度的变化而变化,与浓度无关,故C正确;
D.电离常数只随温度的变化而变化,与浓度无关,所以CH3COOH溶液中加入少量CH3COONa固体,电离常数不变,故D错误.
故选C.
点评 本题考查了电离常数的表达式、影响因素,题目难度不大,注意电离常数是温度的函数只随温度的变化而变化.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HClO4>H2SO4 | D. | 相对分子质量:Ar>K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向该溶液中加入Mg有H2逸出 | |
| B. | 向该溶液中加入少量FeCl2,其离子反应方程式为:2NO3-+6I-+4H2O | |
| C. | 该溶液还可能大量存在MnO4-、ClO- | |
| D. | 向该溶液中逐滴加入Na2CO3溶液至过量,既有气体逸出又有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ③ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )| A. | 头孢羟氨苄可与NaOH溶液反应但不与HCl反应 | |
| B. | 该化合物中含有4个手性碳原子 | |
| C. | 在催化剂存在条件下,1mol头孢羟氨苄可与7molH2发生反应 | |
| D. | 头孢羟氨苄不能在空气中稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
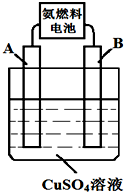 能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com