
分析 (1)实验有两个过程:配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量:所需要的实验仪器主要有烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等;根据以上操作中使用的仪器进行解答;
(2)草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点;
(3)根据实验操作对c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$的影响分析误差;
(4)根据化学方程式中各物质的关系进行计算出草酸的浓度,从而计算出样品中含有草酸的质量、结晶水的质量,最后计算出草酸晶体中x值.
(5)滴定终点时俯视滴定管刻度,会导致测量体积偏小,x值会偏大.
解答 解:(1)为了准确配制一定浓度浓度的草酸溶液,所需要的实验仪器主要为:天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有:烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,
则在以上操作中不需要的仪器有:f.碱式滴定管,
故答案为:f;
(2)KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂
故答案为:锥形瓶内溶液颜色由无色变为浅紫色且30s内不再变色;
(3)在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,蒸馏水不影待测液的物质的量,对V(标准)无影响,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$可知,c(待测)不变,则对所测得的x值无影响,
故答案为:无影响;
(4)2KMnO4 ~5H2C2O4
2 5
aV×10-3mol 0.025×cmol
c=$\frac{5aV×1{0}^{-3}mol}{2×0.025mol}$=0.1aVmol•L-1,
样品中含有草酸的质量为:90g/mol×0.1aVmol/L×0.025L×4=0.9aVg,Wg草酸晶体中含有结晶水的质量为Wg-0.9aVg,
草酸晶体中含有结晶水数目为:x=$\frac{\frac{Wg-0.9aVg}{18g/mol}}{\frac{0.9aVg}{90g/mol}}$=$\frac{50W}{9aV}$-5,
故答案为:$\frac{50W}{9aV}$-5;
(5)滴定终点时俯视滴定管刻度,会导致测量体积偏小,测定草酸浓度偏小,则x值会偏大;
故答案为:偏大.
点评 本题考查一定物质的量浓度溶液配制、滴定操作中仪器的选用及滴定误差分析,题目难度中等,注意掌握配制一定物质的量浓度的溶液即中和滴定操作的方法,能够根据操作步骤选用仪器、根据操作方法判断滴定误差.


科目:高中化学 来源: 题型:选择题
| A. | C2H4、C4H6 | B. | C2H2、C4H8 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
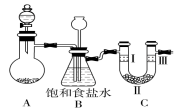 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4v (NH3)=5(O2) | B. | 4 v(NH3)=5 v(H2O) | C. | 4(O2)=5 v(NO) | D. | 4 v(NH3)=5 v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2molC l2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、 I-均氧化 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应:B a2++HCO3-+OH-=B aCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 1mol•L-1的Na[Al(OH)4]溶液和2.5mol•L-1的HCl溶液等体积互相均匀混合:2[Al(OH)4]-+5H+=A l3++Al(OH)3↓+5H2O | 正确;[Al(OH)4]-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| D | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.4 mol/L | B. | c(X2)=0.2mol/L | ||
| C. | c(Y2)=0.4mol/L | D. | c(X2)+c(Y2)+c(Z)=0.6mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com