
【题目】(1)下列离子方程式中,只能表示一个化学反应的是________。(填序号)
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③Cl2+H2O=H++Cl-+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-=AgCl↓
(2)在下列反应中,HCl作还原剂的是________,HCl作氧化剂的是________。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) ![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(3)在横线上补充所需的离子或分子,并配平方程式。
①P+FeO+CaO![]() Ca3(PO4)2+Fe ______
Ca3(PO4)2+Fe ______
②Mn2++ClO3-+H2O=MnO2↓+Cl2↑+________
(4)按要求分别用双线桥或单线桥标出下列反应中电子转移的情况。
①3NO2+H2O=2HNO3+NO(双线桥)____________
②8NH3+6NO2![]() 7N2+12H2O(单线桥)______
7N2+12H2O(单线桥)______
(5)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因:
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到________,其原因是________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会______,原因是______________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会____________,原因是___________________。
【答案】③ ③④ ② 2 P+5 FeO+3 CaO ![]() Ca3(PO4)2+5 Fe 5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+
Ca3(PO4)2+5 Fe 5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+ 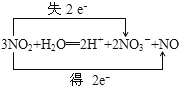
![]() 红褐色液体 FeCl3溶液太稀,生成的Fe(OH)3胶体微粒太少 生成红褐色沉淀 自来水中含有电解质,胶体发生聚沉 生成红褐色沉淀 长时间加热,胶体发生聚沉
红褐色液体 FeCl3溶液太稀,生成的Fe(OH)3胶体微粒太少 生成红褐色沉淀 自来水中含有电解质,胶体发生聚沉 生成红褐色沉淀 长时间加热,胶体发生聚沉
【解析】
(1)根据各离子反应的反应物代表的物质分析判断;
(2)在化学反应中HCl作氧化剂,说明HCl中元素在反应中化合价降低;作还原剂时,所含元素化合价应升高,据此分析解答;
(3)根据得失化合价升降守恒配平方程式;
(4)根据化合价的变化分析判断转移的电子数,再根据要求分析书写转移电子的方向和数目;
(5)按照氢氧化铁胶体的制备方法结合胶体的性质分析解答。
(1)①Fe+Cu2+═Fe2++Cu表示铁与可溶性铜盐反应,表示一类反应,故①不选;
②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O表示氢氧化钡与可溶性硫酸氢盐或者硫酸反应,表示一类反应,故②不选;
③Cl2+H2O═H++Cl-+HClO表示氯气与水反应,只表示一个反应,故③选;
④CO32-+2H+═CO2↑+H2O表示强酸与可溶性碳酸盐反应,表示一类反应,故④不选;
⑤Ag++Cl-═AgCl↓表示硝酸银与可溶性盐酸或氯化物反应,表示一类反应,故⑤不选;
只表示一个反应的是③,故答案为:③;
(2)①CaCO3+2HCl=CaCl2+CO2↑+H2O反应中各元素化合价都不变,属于非氧化还原反应;
②Fe+2HCl=FeCl2+H2↑中H元素化合价降低,被还原,HCl为氧化剂;
③PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O 中Cl元素化合价升高,被氧化,反应中HCl为还原剂;
PbCl2+Cl2↑+2H2O 中Cl元素化合价升高,被氧化,反应中HCl为还原剂;
④KClO3+6HCl(浓) ![]() KCl+3Cl2↑+3H2O中,KClO3为氧化剂,HCl为还原剂;
KCl+3Cl2↑+3H2O中,KClO3为氧化剂,HCl为还原剂;
⑤CuO+2HCl=CuCl2+H2O中元素化合价没有发生变化,不是氧化还原反应;
HCl作还原剂的是③④,HCl作氧化剂的是②;故答案为:③④;②;
(3)①P+FeO+CaO![]() Ca3(PO4)2+Fe中元素的化合价变化为:P→Ca3(PO4)2,磷元素由0价→+5价,一个磷原子失5个电子;FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为2 P+5 FeO+3 CaO
Ca3(PO4)2+Fe中元素的化合价变化为:P→Ca3(PO4)2,磷元素由0价→+5价,一个磷原子失5个电子;FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为2 P+5 FeO+3 CaO ![]() Ca3(PO4)2+5 Fe,故答案为:2 P+5 FeO+3 CaO
Ca3(PO4)2+5 Fe,故答案为:2 P+5 FeO+3 CaO ![]() Ca3(PO4)2+5 Fe;
Ca3(PO4)2+5 Fe;
②Mn2+转化为MnO2,失去2个电子,ClO3-转化为氯气,得到10个电子,根据氧化还原反应中得失电子相等,故 Mn2+的计量数为5,ClO3-的计量数为2,结合原子守恒,还缺少H+,所以反应的方程式是:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,故答案为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;
(4)①3NO2+H2O===2HNO3+NO反应中,只有氮原子化合价变化,电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
②在反应8NH3+6NO2=7N2+12H2O中,NH3→N2,化合价变化为-3价→0价,NH3是还原剂,失8×3e-,NO2→N2,化合价变化为+4价→0价NO2是氧化剂,得6×4e-,可表示为![]() ,故答案为:
,故答案为:![]() ;
;
(5)①实验室制备氢氧化铁胶体的方法为:向沸水中滴加饱和氯化铁溶液加热到红褐色,将稀氯化铁溶液滴入沸水中,FeCl3溶液太稀,生成的Fe(OH)3太少,无红褐色,故答案为:红褐色液体;FeCl3溶液太稀,生成的Fe(OH)3胶体微粒太少;
②自来水生产时需向水中通入氯气,氯气遇水会产生次氯酸HClO,用于消毒,同时生成盐酸,盐酸、HClO电解质电离生成的阴离子Cl-、ClO- 中和了 Fe(OH)3 胶粒所带的正电荷,使胶粒聚集成较大的颗粒而形成红褐色沉淀,故答案为:生成红褐色沉淀;自来水中含有电解质,胶体发生聚沉;
③制备氢氧化铁胶体时,当溶液呈红褐色时应停止加热,否则生成的胶体在加热条件下发生聚沉,形成红褐色沉淀,故答案为:生成红褐色沉淀;长时间加热,胶体发生聚沉。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 0.1 mol H2和0.1 mol I2在密闭容器中充分反应后,其分子总数等于0.2 NA
B. 向密闭容器中充入2 mol NO2一段时间后,容器中的分子数为2 NA
C. 1 L 0.1 mol/L H3PO4溶液中含H+数目为0.3 NA
D. 1 L 0.1 mol/L NH4Cl溶液中含有NH4+数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。

(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__、__个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是__.该物质的化学式可表示为__。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛离子之间的距离)为dnm(1nm=10﹣9m),则该晶体的密度为__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:

下列有关叙述正确的是( )
A. 1mol克利贝特与足量的Na反应能生成22.4L的H2
B. 物质X分子中所有碳原子可能位于同一平面内
C. 1mol物质X最多可以与含2mol Br2的溴水反应
D. 用饱和NaHCO3溶液可以鉴别物质X和克利贝特
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是____________________________________。
②试剂a是____________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________。
(3)根据沉淀F的存在,推测![]() 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,![]() 被氧化为
被氧化为![]() 进入D。
进入D。
实验三:探究![]() 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______。
②实验三的结论:__________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和![]() 生成。
生成。
(6)根据上述实验所得结论:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠晶体为体心立方晶胞,实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期A,B,C,D,E、X六种元素,已知B,C,D,E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C,D,E三种原子第一电离能由大到小的顺序为__。
(2)A原子与B,C,D原子形成最简单化合物的稳定性由强到弱的顺序为__,根据价层电子对互斥理论预测BA2D的分子构型为__。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC﹣.与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上,根据其结构特点可知该晶体的化学式为____(用最简正整数表示)。
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:

根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是__,MgO晶体中一个Mg2+周围和它最邻近且等距离的O2﹣有__个。
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol·L1氨水中滴加0.lmol·L1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a >b>c
⑥NaHSO3溶液显酸性,c(Na+)>c(HSO3-)>c(H+)>c(OH-)>c(SO32-)
⑦常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
⑧pH=3.6的0.1mol/L HX与0.1mol/L NaX的混合溶液中,c(H+)-c(OH-)=c(X-)-c(HX)
A. ②④⑥⑦ B. ②⑤⑦⑧ C. ①③⑤⑥ D. ②⑤⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com