
| A、①⑥⑦ | B、①④⑤ |
| C、③⑦⑧ | D、③⑥⑦⑧ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
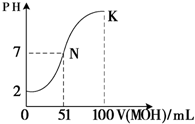 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
209 83 |
210 83 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中可能发生:Z2+2A2+═2A3++2Z- |
| B、Z2在①、③反应中均为氧化剂 |
| C、氧化性强弱顺序为:XO4->Z2>B2>A3+ |
| D、X2+是XO4-的还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O |
| B、铁和稀硫酸反应:Fe+2H+═H2↑+Fe3+ |
| C、NH4HCO3溶液中加入过量的NaOH溶液:NH4++OH-═NH3+H2O |
| D、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6:3:2 |
| B、1:1:1 |
| C、3:2:1 |
| D、1:2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com