下列化合物:①HCl ②NaOH ③CH
3COOH ④NH
3?H
2O ⑤CH
3COONa ⑥NH
4Cl ⑦C
2H
5OH ⑧SO
2(1)属于弱电解质的是
,溶液呈碱性的有
(填序号).
(2)常温下0.01mol/L NaOH溶液的pH=
;pH=11的CH
3COONa溶液中由水电离产生的c(OH
-)=
.
(3)用离子方程式表示CH
3COONa溶液呈碱性的原因
,其溶液中离子浓度按由大到小的顺序为
.
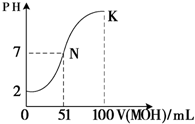
(4)常温下,向100mL 0.01mol?L
-1 HA溶液逐滴加入0.02mol?L
-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
酸(填“强”或“弱”).
②在滴加过程中,水的电离程度的变化是先
后
(填“增大”、“减小”或“不变”).
③K点对应的溶液中,c(M
+)+c(MOH)=
mol?L
-1.
(5)在25℃下,向浓度均为0.01mol?L
-1的FeCl
3和CuCl
2混合溶液中逐滴加入氨水,先生成
沉淀(填化学式),当测得溶液pH=11时,则此温度下残留在溶液中的c(Cu
2+):c(Fe
3+)=
.
(已知25℃时Ksp[Fe(OH)
3]=4.0×10
-38,Ksp[Cu(OH)
2]=2.2×10
-20)
(6)25℃时,将bmol NH
4NO
3溶于水,向该溶液滴加a L氨水后溶液呈中性,则所滴加氨水的浓度为
mol?L
-1.(NH
3?H
2O的电离平衡常数取K
b=2×10
-5mol?L
-1)

 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2




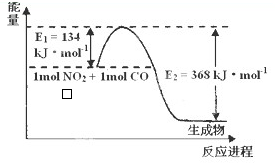 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下: 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: