
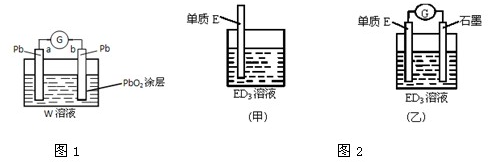
 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
| ||
| 0.02mol |
| 0.2L |


科目:高中化学 来源: 题型:
| A、制备Al2O3:将AlCl3溶液蒸干灼烧 |
| B、制备Fe(OH)3胶体:向沸水中滴加几滴FeCl3饱和溶液继续加热至红褐色 |
| C、检验溶液中是否含有CO32-:向某溶液中加入稀H2SO4,将产生的气体通入澄清石灰水 |
| D、比较CH3COO-和CO32-结合H+的能力强弱:相同温度下,测定浓度分别为0.1mol/L的Na2CO3和CH3COONa溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:


| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
209 83 |
210 83 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只含非金属元素的离子一定是阴离子 |
| B、某元素由化合态变成游离态一定被还原 |
| C、金属阳离子被还原不一定得到金属单质 |
| D、含金属元素的离子只能是阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com