


| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |

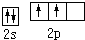 ,元素⑩是Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,
,元素⑩是Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,
 ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;| 1 |
| 8 |
| 1 |
| 2 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量的氨水 Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| C、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| D、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化):
利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com