
【题目】(双选)下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:![]() —X,
—X,![]() —Y,×—Z)( )
—Y,×—Z)( )
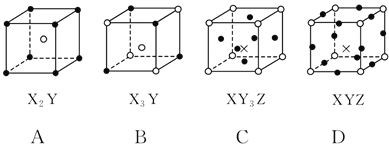
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】某无色溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )
A.Na+、Al3+、NO3-、Cl-B.K+、Na+、Cl-、SO42-
C.MnO4-、K+、SO42-、Cl-D.Na+、HCO3-、K+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂是锂电池的电极材料,其成分为LiFePO4、 碳粉和铝箔。对该材料进行资源回收研究,设计实验流程如下:
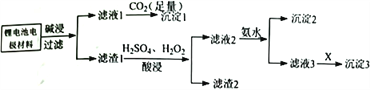
已知:溶解度表:
Li2CO3 | LiOH | LiI | |
0℃ | l.54g | 12.7g | 151g |
100℃ | 0.72g | 13.6g | 179g |
回答下列问题:
(1)由滤液1到沉淀1反应的离子方程式为_______________________________。
(2)向滤渣1加入H2SO4、H2O2混合溶液时,磷酸铁锂溶解,反应的离子方程式为__________________________________。
(3)对滤渣1酸浸操作,下列实验条件控制正确的是(填字母代号) _________________。
a.加入H2O2溶液适当过量,有利于滤渣1的转化
b.适当提高硫酸溶液浓度并搅拌
c.用HNO3代替所加H2SO4和H2O2,节约药品更环保
(4)滤液2加氨水时,调节pH=3,此时溶液中c(Fe3+)=________ (常温下,Ksp[Fe(OH)3]=4.0×10-38)。
(5)向滤液3中加入物质X,根据溶解度表判断X可能是:___________ (填Na2CO3、NaOH或Nal)。
(6)对沉淀3进行洗涤操作,应选择________(选填“冷水”或“热水”)进行洗涤。
(7)磷酸铁锂电池的工作原理为:LiFePO4+ 6C![]() Li1-xFePO4 +LixC6,电池中的电解质可传导Li+。放电时正极的电极反应式为________________________________。
Li1-xFePO4 +LixC6,电池中的电解质可传导Li+。放电时正极的电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第________周期第________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是________(写化学式)。
(2)W的基态原子核外电子排布式是___________________________________。
(3)W2Y在空气中煅烧生成W2O的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科技工作者对含有碳杂质的金属铝的腐蚀与溶液酸碱性的关系进行了研究,在25℃时得出溶液pH值对铝的腐蚀影响关系如图所示,下列说法正确的是( )
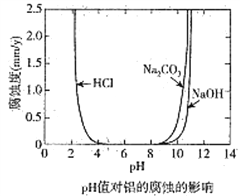
A. 金属铝在浓硫酸中的腐蚀速率大于盐酸中的腐蚀速率
B. 金属铝在中性环境中不易被腐蚀
C. 金属铝在pH=8.5的Na2CO3溶液中会发生电化学腐蚀析出氧气
D. 不能用电解的方法在金属铝的表面生成致密的氧化物薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
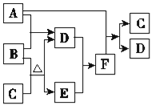
(1)写出微粒的空间构型:A________、C________。
(2)六种微粒中互为等电子体的是________(写微粒的化学式)。
(3)A~E五种微粒中含有配位键的是________(写微粒的化学式)。
(4)E易溶于D,其原因是_________________。
(5)将过量的F滴加到CuSO4溶液中,生成深蓝色的溶液,该深蓝色物质的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水、废渣不经处理,会对环境造成很大的危害。利用化学原理可以对工厂排放的废水、废渣等进行有效检测、处理及应用。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,Cr(Ⅲ)最终转化为CrOH(H2O)5SO4。
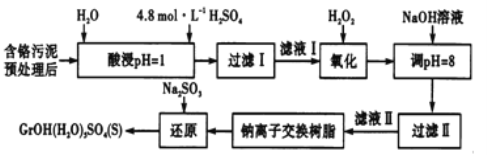
常温下,部分阳离子以氢氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒、量筒和胶头滴管外,还需_______,配制时所需浓H2SO4的体积为_______mL(小数点后保留一位数字)。
(2)酸浸时,为了提高浸取率,除了适当增大酸的浓度外,还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(5)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______。
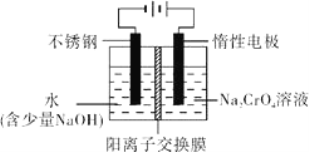
(6)工业上还可用电解法制备重铬酸钠,其装置示意图如图.阴极的电极反应式为____________,阳极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com