
����Ŀ��X��Y��Z��W��Ԫ�����ڱ�ǰ�������е����ֳ���Ԫ�����������Ϣ���±���
Ԫ�� | �����Ϣ |
X | X�Ļ�̬ԭ�Ӻ���3���ܼ����е�������ÿ���ܼ��ϵĵ�������� |
Y | ���³�ѹ����Y�����ǵ���ɫ���������ڻ�ɽ�ڸ������� |
Z | Z��Yͬ������Z�ĵ縺�Դ���Y |
W | W��һ�ֺ��ص�������Ϊ63��������Ϊ34 |
��1��Yλ��Ԫ�����ڱ���________���ڵ�________����Y��Z������������Ӧ��ˮ��������Խ�ǿ����________(д��ѧʽ)��
��2��W�Ļ�̬ԭ�Ӻ�������Ų�ʽ��___________________________________��
��3��W2Y�ڿ�������������W2O�Ļ�ѧ����ʽ��________________________��
���𰸡� �� ��A HClO4 1s22s22p63s23p63d104s1(��[Ar]3d104s1) 2Cu2S��3O2![]() 2Cu2O��2SO2
2Cu2O��2SO2
��������������Ҫ����Ԫ�����ڱ���Ԫ�������ɡ������������Ƶ�X��Y��Z��W�ֱ�ΪC��S��Cl��Cu��
(1)Sλ��Ԫ�����ڱ��ĵ������ڵ���A�塣�ǽ�������Cl>S������������������Ӧ��ˮ��������Խ�ǿ����HClO4��
(2)ͭ�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d104s1��
(3)Cu2S��O2������Ӧ����Cu2O��SO2���壬��Ӧ�Ļ�ѧ����ʽΪ2Cu2S��3O2![]() 2Cu2O��2SO2��
2Cu2O��2SO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������˵�����������������ǣ� ��
A. �����¶Ȼ����������������Ըı仯ѧ��Ӧ�ķ�Ӧ��
B. ̫���ܵ�ؽ���ѧ��ת��Ϊ����
C. ��ƽ�����ת��Ϊ��ѧ��
D. ���ʷ�����ѧ�仯��һ�������������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���Ϊͬλ�ص���( )
A.O2��O3��O4
B.12
C.13
D.14C C. H2O��D2O��T2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���衢��ͭ�����ĵ��ʼ����������ִ���ҵ���������Ź㷺Ӧ�á��ش��������⣺
��1����̬Cu+�ĺ���۲�����Ų�ʽΪ_______________��Be��B��Al�ĵ�һ�������ɴ�С��˳����______________________________��
��2���������������Ԫ���γ���̬�⻯�����Si-H���й��õ��Ӷ�ƫ����Ԫ�أ�����������Ӧʱ�����������������������ĵ縺����Դ�СΪSe___ Si(�>������<��)��
��3��SeO32-��Seԭ�ӵ��ӻ�����Ϊ______�����以Ϊ�ȵ������һ�ַ��ӵķ���ʽ��______________��
��4��CuSO4��Cu(NO3)2����Ȼ������Ҫ��ͭ�Σ���CuSO4��Һ�м������ϡ��ˮ�������������ӵĿռ乹��Ϊ_________��Cu(NO3)2�еĻ�ѧ�����˦Ҽ��⣬������_______________��
��5������(BP)��һ����ĥ���ϣ��۵�ߣ��侧���ṹ��ͼ��ʾ���þ�����B�Ķѻ���ʽΪ___________����֪�þ���ľ�������a pm����NA���������ӵ�������ֵ����þ�����ܶ�Ϊ____ g��cm-3�����ɾ������������֮����������Ϊ__________pm��
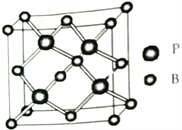
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��Ϊͬ���칹�壬����˵������ȷ����
��Ϊͬ���칹�壬����˵������ȷ����
A. z�Ķ��ȴ���������
B. x��y��һ�ȴ����ֻ������
C. x��y ��ʹ������Ȼ�̼��Һ�����ӳɷ�Ӧ����ɫ
D. x��y��z��ֻ��x������ԭ�ӿ��ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Ԫ�����ʵݱ����ʵ��ʱ�������һ��ʵ�鷽������¼���й�ʵ������
ʵ�鲽�� | ʵ������ |
�� ��þ����ɰֽ��ĥ�����Թ��У���������ˮ������ˮ���ڣ�������Һ�еμӷ�̪��Һ | A������ˮ���ϣ��۳�С���Ĵ��ζ���������˻˻��������֮��ʧ����Һ��ɺ�ɫ |
�ڽ�һС������Ʒ�����з�̪��Һ����ˮ�� | B���������������Һ���dz��ɫ |
�۽�þ��Ͷ��ϡ������ | C����Ӧ��ʮ�־��ң�������ɫ���� |
�ܽ�����Ͷ��ϡ������ | D�����ҷ�Ӧ��Ѹ�ٲ���������ɫ���� |
�������ͬѧ���������ʵ�鱨�档
��1��ʵ��Ŀ�ģ��о�_________________Ԫ�����ʵݱ���ɡ�
��2��ʵ�����ݣ�����д��ʵ�鲽���Ӧ��ʵ������ı�ţ�
ʵ������ | �� | �� | �� | �� |
ʵ��������A~D�� | _________ | ______ | _______ | ___________ |
��3��д��ʵ���\�ڶ�Ӧ��ѧ����ʽ
ʵ��� ______________________________________________________________________��
ʵ���_______________________________________________________________________��
��4��ʵ����ۣ�______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(˫ѡ)��ͼ��ʾ�Ǿ���ṹ�о��д����Ե���С�ظ���Ԫ(����)�����з�ʽ�����Ӧ�Ļ�ѧʽ��ȷ����(ͼ�У�![]() ��X��
��X��![]() ��Y������Z)(����)
��Y������Z)(����)
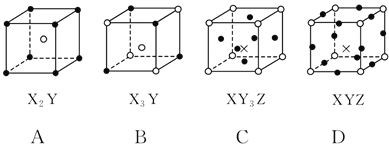
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ŀ��Ϣ������з���ʽ��
(1)��(Ti)��Ϊ�������������Խ��Խ�������ǵĹ�ע���ؿ��к�������ʯ֮һ�ǽ��ʯ(TiO2)��Ŀǰ���ģ�����ķ����ǣ�
��һ�������ʯ��̿�ۻ�ϣ��ڸ��������£�ͨ��Cl2�Ƶ�TiCl4��һ�ֿ�ȼ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ��____________________________________________��
�ڶ�����������������У��ù�����þ�ڼ�����������TiCl4��Ӧ�Ƶý����ѡ�д���˷�Ӧ�Ļ�ѧ����ʽ��____________________________________________��
(2)��100mL 0.1mol/L��NaOH��Һ����224mLCO2����(��״��)��ǡ����ȫ���ա��ٽ�������Һ����100mL 0.1mol/L����������Һ�С���д��������Һ������������Һ��Ӧ�����ӷ���ʽ��_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д���������ǣ� ��
A.H+��ClO-��Cl-��SO42-B.Na+��H+��CO32-��NO3-
C.Na+��H+��Cl-��NO3-D.K+��H+��SO42-��OH-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com