
下列装置或操作不能实现实验目的的是
|
|
|
|
A.吸收易溶于水的气体 | B. 实验室制取氨气 | C.配制银氨溶液 | D.实验室制乙烯 |
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有机反应中,不属于取代反应的是
A.CH4+Cl2  CH3Cl+HCl
CH3Cl+HCl
B.2CH3CHO+O2 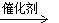 2CH3COOH
2CH3COOH
C.CHCl3+HF CHFCl2+HCl
CHFCl2+HCl
D.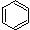 +Br2
+Br2 
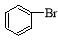 +HBr
+HBr
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是
A.若a≤b,混合液的pH一定小于7
B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立
D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
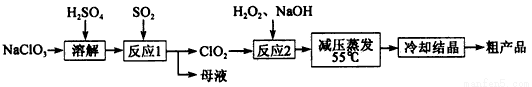
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
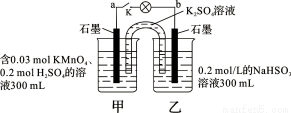
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:填空题
(14分)甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
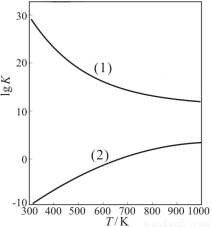
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
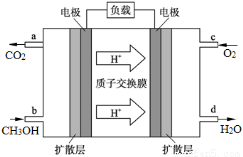
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
下列有关溶液配制操作对溶液浓度的影响和原因分析都正确的是
选项 | 溶液配制操作 | 影响 | 原因分析 |
A | 将2 g I2加入到98 mL CCl4中溶解混匀后,即得质量分数为2%的I2的CCl4溶液 | 偏小 | CCl4的密度 大于1 g/mL |
B | 配制一定浓度的溶液时,将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外 | 偏小 | 洒出的溶液中含有溶质 |
C | 配制一定物质的量浓度的硝酸溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余 的水 |
D | 配制一定物质的量浓度的食盐溶液,定容,摇匀后发现液面低于刻度线 | 偏大 | 液体的体积 偏小 |
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:计算题
(12分)接触法制硫酸采用V2O5作催化剂,使用过的催化剂中含V2O5、VOSO4和SiO2,其中VOSO4能溶于水,从使用过的V2O5催化剂中回收V2O5的主要步骤是:向使用过的催化剂中加硫酸和Na2SO3浸取还原,过滤得VOSO4溶液;向滤液中加入KClO3氧化,再加入氨水生成沉淀;将沉淀焙烧处理后得V2O5。
(1) V2O5被浸取还原的反应产物之一是VOSO4,该反应的化学方程式为____。
(2) 若生产过程使用的硫酸用量过大,进一步处理时会增加________的用量。氨气常用________检验,现象是________________________。
(3) 若取加入氨水后生成的沉淀(其摩尔质量为598 g·mol-1,且仅含有四种元素)59.8 g充分焙烧,得到固体残留物54.6 g,同时将产生的气体通过足量碱石灰,气体减少了1.8 g,剩余的气体再通入稀硫酸则被完全吸收。通过计算确定沉淀的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3 、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com