
【题目】(化学——选修5:有机化学基础)
化合物G是一种有机光电材料中间体。由A制备G的一种合成路线如下图所示:
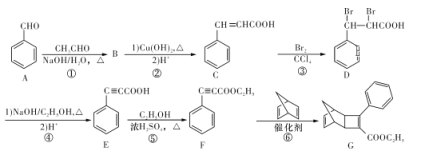
请回答下列问题:
(1)F中官能团的名称为___________。
(2)B的分子式为C9H8O,B→C的过程中第一步反应的化学方程式为_________________。
(3)反应②~⑥中属于取代反应的是___________(填序号)。
(4)在镍的催化作用下,E与足量的氢气加成所得的产物分子中有___________种不同环境的氢原子。
(5)一定条件下以F为单体发生加聚的反应方程式为___________。
(6)C有多种同分异构体,其中同时满足下列条件的同分异构体有_________种。
①能发生银镜反应;
②能发生水解反应;
③能与溴的CCl4溶液发生加成反应;
④属于芳香族化合物。
(7)请写出以![]() 和CH3C≡CH为原料制备
和CH3C≡CH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干中合成路线)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干中合成路线)。____________
【答案】酯基、碳碳三键 ![]() ⑤ 7
⑤ 7 ![]() 5
5 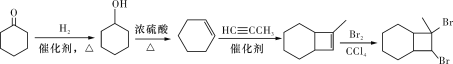
【解析】
由信息①可知A为![]() ,C为
,C为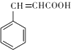 ,则B为
,则B为![]() ,D为
,D为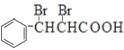 ,E为
,E为![]() ,与乙醇发生酯化反应生成F为
,与乙醇发生酯化反应生成F为![]() , G为
, G为![]() ,以此解答(1)~(4);
,以此解答(1)~(4);
(5)F为![]() ,碳碳三键发生加聚反应;
,碳碳三键发生加聚反应;
(6)C为 ,不饱和度为=6,苯环上连接着三种不同官能团,能发生银镜反应,分子中含有醛基-CHO,能与Br2/CCl4发生加成反应,含有不饱和的碳碳键,由于苯环的不饱和度为4,-CHO的不饱和度为1,故不饱和的碳碳键的不饱和度为6-4-1=1,故为C=C双键,能发生水解反应,说明为甲酸酯;
,不饱和度为=6,苯环上连接着三种不同官能团,能发生银镜反应,分子中含有醛基-CHO,能与Br2/CCl4发生加成反应,含有不饱和的碳碳键,由于苯环的不饱和度为4,-CHO的不饱和度为1,故不饱和的碳碳键的不饱和度为6-4-1=1,故为C=C双键,能发生水解反应,说明为甲酸酯;
(7)环己酮和丙炔为原料制备化合物![]() ,环己酮应先生成环己醇,然后与丙炔发生加成反应生成
,环己酮应先生成环己醇,然后与丙炔发生加成反应生成![]() ,最后与溴发生加成可生成
,最后与溴发生加成可生成![]() ,以此解答该题。
,以此解答该题。
(1)由以上分析可知F为![]() ,含有的官能团为酯基、碳碳三键,
,含有的官能团为酯基、碳碳三键,
故答案为:酯基、碳碳三键;
(2)B为![]() ,C为
,C为 ,B→C的过程中第一步反应的化学方程式为
,B→C的过程中第一步反应的化学方程式为![]()
故答案为:![]() ;
;
(3)由以上分析可知反应②~⑥中,②为氧化反应,③为加成反应,④为消去反应,⑤为取代反应,⑥为加成反应,因此属于取代反应的是⑤,
故答案为:⑤;
(4)E为![]() ,在镍的催化作用下,E与足量的氢气加成所得的产物分子为
,在镍的催化作用下,E与足量的氢气加成所得的产物分子为![]() ,根据分子的对称性,共有7种不同环境的氢原子。
,根据分子的对称性,共有7种不同环境的氢原子。
故答案为:7;
(5)F为![]() ,一定条件下以F为单体发生加聚的反应方程式为
,一定条件下以F为单体发生加聚的反应方程式为![]() 。
。
故答案为:![]() ;
;
(6)C为 ,不饱和度为=6,苯环上连接着三种不同官能团,能发生银镜反应,分子中含有醛基-CHO,能与Br2/CCl4发生加成反应,含有不饱和的碳碳键,由于苯环的不饱和度为4,-CHO的不饱和度为1,故不饱和的碳碳键的不饱和度为6-4-1=1,故为C=C双键,能发生水解反应,说明为甲酸酯,符合题意的有
,不饱和度为=6,苯环上连接着三种不同官能团,能发生银镜反应,分子中含有醛基-CHO,能与Br2/CCl4发生加成反应,含有不饱和的碳碳键,由于苯环的不饱和度为4,-CHO的不饱和度为1,故不饱和的碳碳键的不饱和度为6-4-1=1,故为C=C双键,能发生水解反应,说明为甲酸酯,符合题意的有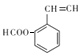 、
、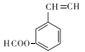 、
、 、
、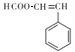 、
、 共5种;
共5种;
故答案为:5;
(7)环己酮和丙炔为原料制备化合物![]() ,环己酮应先生成环己醇,然后与丙炔发生加成反应生成
,环己酮应先生成环己醇,然后与丙炔发生加成反应生成![]() ,最后与溴发生加成可生成
,最后与溴发生加成可生成![]() ,合成路线为:
,合成路线为: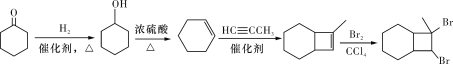
故答案为: 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2(g)+SO2(g)![]() NO(g)+ SO3(g),平衡时,下列叙述正确的是
NO(g)+ SO3(g),平衡时,下列叙述正确的是
①NO和SO3的物质的量一定相等
②NO2和SO2的物质的量一定相等
③体系中的总物质的量一定等于反应开始时总物质的量
④SO2、NO2、NO、SO3的物质的量一定相等
A. ①和②B. ②和③C. ①和③D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于处于化学平衡状态的反应C(s)+H2O(g)![]() CO(g)+H2(g);ΔH>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
CO(g)+H2(g);ΔH>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
A. 增大H2O(g)的浓度 B. 升高温度
C. 降低压强 D. 增加碳的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在苯的同系物中.加入少量酸性高锰酸钾溶液.振荡后褪色.正确的解释是( )
A.苯的同系物分子中.碳原子数比苯多
B.苯环受侧链影响.易被氧化
C.侧链受苯环影响.易被氧化
D.由于侧链与苯环的相互影响.使侧链和苯环均易被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质的结构与性质)
钛有“生物金属”和“未来金属”之称,钛及其化合物的应用正越来越受到人们的关注。
(1)基态钛原子外围电子的轨道表达式为___________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有___种。
(2)金属钛的熔点、硬度均比铝大,可能的原因是____。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是__________ (填化学式)。

(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图所示。
①组成该物质的元素中,电负性最大的是__________ (填元素名称)。
②M中碳原子的杂化形式有___________种。
③M中不含__________ (填字母代号)。
a.π键 b.σ键 c.配位键
d.氢键 e.离子键

(5)①金属钛晶体中原子采用面心立方最密堆积,则晶胞中钛原子的配位数为_____。
②设钛原子的直径为d cm,用NA表示阿伏加德罗常数的值,钛原子的摩尔质量为M g·mol-1,则晶体钛的密度为________g·cm-3。
③金属钛晶胞中有若干个正四面体空隙,如图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙,可以填充其他原子。若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展煤化工是推动山西能源革命的重要力量,煤的干馏是煤化工的一种重要途径。
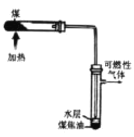
(1)煤的干馏属于_____________变化(填“物理”或“化学”)。
(2)煤干馏后得到的固体物质主要是___________,得到的可燃性气体中的一种成分是___________。
(3)煤焦油中含有苯, 用苯制硝基苯的化学方程式是_________,该反应类型属于_________。
(4)煤焦油经过分馏可以得到萘(![]() ),其分子式是_____________.
),其分子式是_____________.
(5) 为证明上图实验中得到的水层含有氨,可进行的实验操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为________________
②该反应的热化学方程式为_____________________
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=____________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com